参考文献:Microfluidic Biochips for Single-Cell Isolation and Single-Cell Analysis of Multiomics and Exosomes
文中详细讨论基于微流控技术的各种单细胞分离和分析技术。
包括工作原理、分离机制、芯片特性及其对细胞功能活性的影响,特别是在多组学和外泌体的分析中。
介绍了相关研究进展和重要成果,总结了不同芯片在不同研究领域的优缺点和适用性。
1. 微室单细胞分离芯片
在众多微流控芯片中,微室芯片结合单细胞打印方法,可以实现单细胞的高活性分离和培养。
微室芯片朝上放置,细胞溶液以上下移动的方式打印到每根柱子上,单细胞在重力作用下以泊松分布概率落入每个微室,从而实现温和的单细胞分离(图A)。
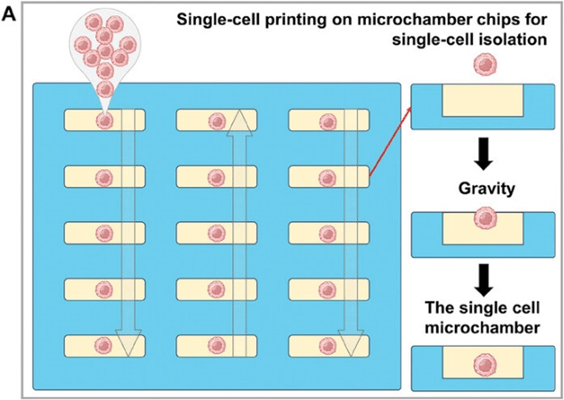
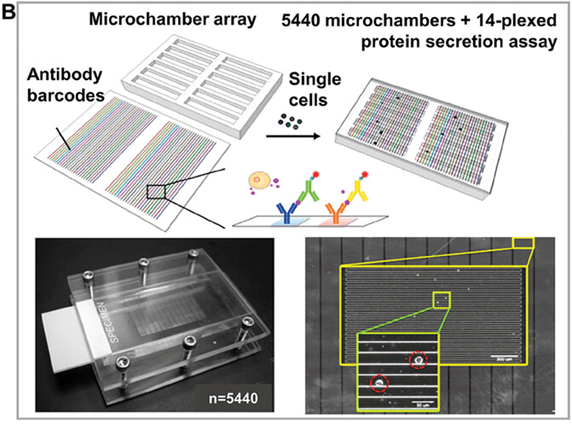
在软光刻技术的帮助下,数以千计的微室阵列被集成到了极小的芯片上,进一步提高了单细胞通过率。
该技术结合了空间编码和光谱编码,可在单细胞水平检测 14 种免疫效应蛋白(图B)。
根据所需的检测因子数量,可以在不影响检测性能的前提下,以牺牲芯片或微室尺寸为代价,进一步提高通量(图C)。

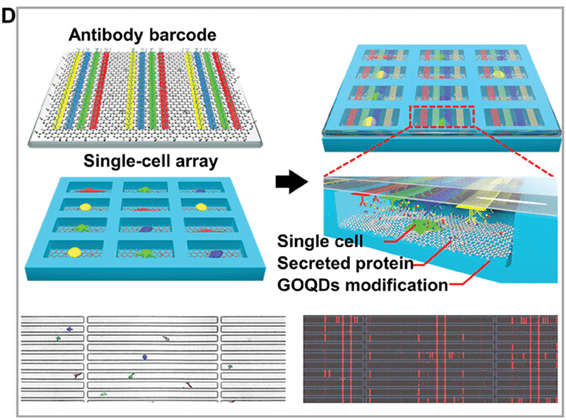
研究人员开发了一种结合微流体技术和机器学习的高通量、活体、单细胞、多标记分泌型生物标记分析平台。
该平台利用组装有氧化石墨烯量子点(GOQDs)的微室芯片,不仅确保了单细胞的高活性培养,还实现了肿瘤细胞的高精度分类(图D)。
2. 双层阀单细胞隔离芯片
双层阀门芯片是另一种可实现高活性单细胞隔离的芯片。它由阀门层和流道层组成。
在流道层,根据细胞密度和细胞特性设计微通道的宽度、深度和几何形状,以确保细胞流速,使细胞能均匀地进入腔室。
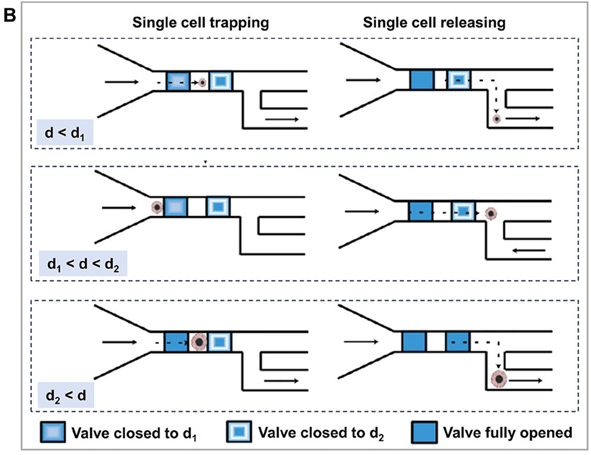
在阀门层,使用气体或液体精确控制阀门的打开和关闭,以隔离腔室内的单细胞,实现单细胞分离(图A)。

一些研究通过控制不完全关闭流道层的微阀来筛选、捕获和释放不同大小范围的单细胞。
它们直接印制在标准微孔板上,为单细胞分析提供了高效、精确的工具(图B)。
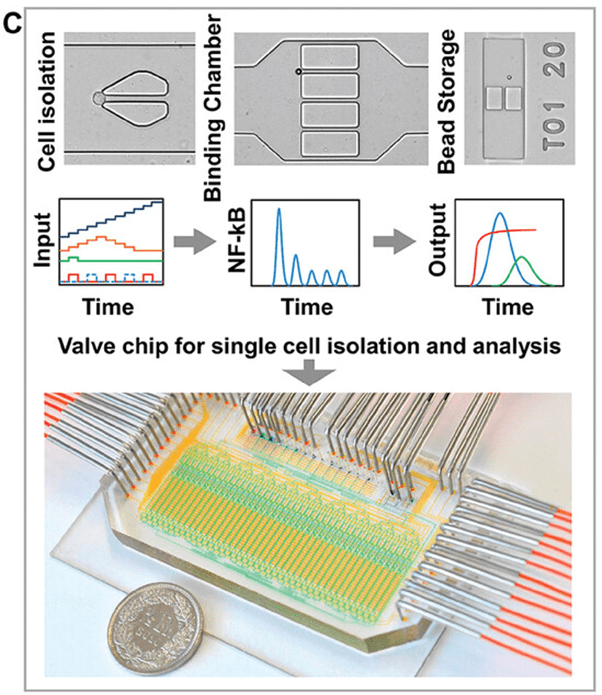
在一些研究中,自动微流控阀门被用于向 40 个腔室中的单个活体巨噬细胞提供精确定义的动态输入,同时施加动态刺激,实现可靠的分离、培养,以及随后对包括粘附细胞在内的多种细胞类型进行多重关键免疫参数分析(图C)。
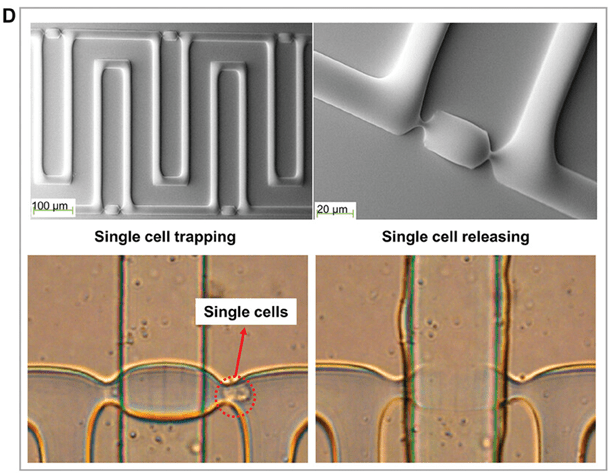
还有研究利用阀门开关分离、筛选和回收细胞,分离效率超过 95%。
利用这种芯片和高分辨率成像系统,可以选择性地分离、筛选和回收单个小鼠胚胎干细胞,而不影响细胞活性(图D)。
3. 微滴单细胞分离芯片
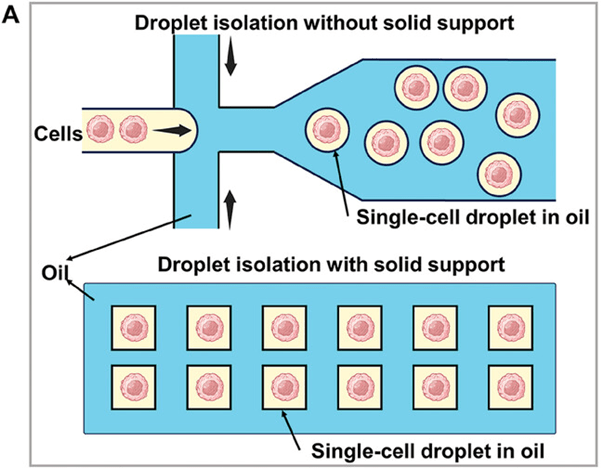
液滴微流控芯片利用交错的油水通道产生液滴来包裹和分离单细胞,被认为是最有前途的单细胞分离和分析平台之一。
目前,它主要分为无固体支撑和有固体支撑两种模式。
(图A)通过调节细胞浓度、悬浮介质密度和流速来控制液滴含有单细胞的概率。
一些研究提出了用于大规模生产大小和成分可控的单液滴和复合液滴的微流体模块,从而实现了更高通量的分析,并为液滴的工业化生产提供了可行的解决方案(图B)。

在一些研究中,细胞被分离成凝胶液滴,为维持正常的细胞形态提供坚实的支持。
该平台实现了微孔板的核心功能,包括微滴内容的封装、实时监测和选择性提取。
这项研究在 2D 阵列中封装和培养数千个细菌细胞,证明了该平台在细菌学研究中的潜在应用(图C)。
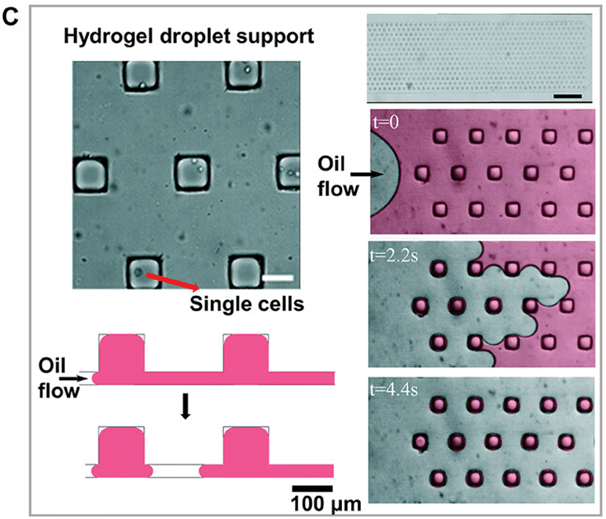
此外,液滴还可印刷到基底上,以提供固体支持。
该技术利用荧光激活液滴分拣机和特殊设计的基底,以高通量有效构建液滴、细胞和微颗粒的复杂阵列,为单细胞分析和多样化检测提供了新的解决方案(图D)。

4. 微孔单细胞分离芯片
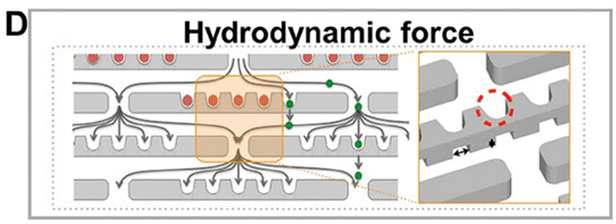
微孔阵列芯片通常利用重力、离心力、流体动力或介电泳力将单细胞分离到根据细胞大小设计的捕集器中,实现单细胞分离。
(图A)在分离过程中,细胞没有进入单细胞进入的微孔。
它们通过重力、离心力、流体动力或介电泳力继续进入周围的微孔,从而实现高通量、高效率的单细胞分离。

一个研究方向是利用离心力和截锥形微孔结构,使单细胞分离效率达到 90%,在 1 平方厘米的芯片上,单细胞分离量在几秒钟内超过 10000 个,实现了高效、高通量的单细胞凋亡实时观察(图B)。

另一个研究方向是利用重力进行单细胞分离,并开发了一种称为一步微成型的技术。
这种方法成功地制造出了类似日本清酒容器形状的结构,旨在增加微孔的反应体积,用于反转录聚合酶链反应或基因组扩增等相关应用(图C)。
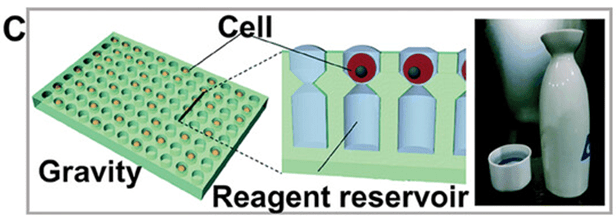
还有研究人员利用重力将单个 MCF-7 细胞分离到微孔阵列中,用油隔离以防止串扰,并采用双纳米孔技术对分泌的活性氧进行电学检测。
借助流体力学,多级分离和筛选微流控芯片使用底部带有不同大小孔的捕集器,提供 40、30、20 和 15 微米的 4 级逐层过滤。
利用每层相应大小的孔分离腹水中的癌细胞,随后对细胞表面生物标记物进行荧光分析(图D)。
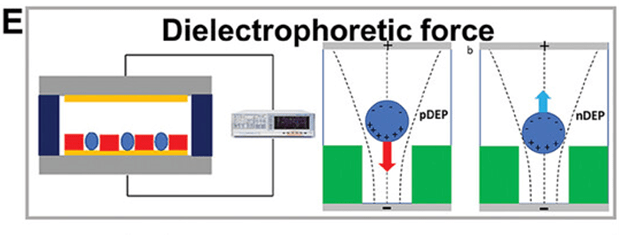
还有一些研究利用介电泳捕获了微孔中的单个 PC-3 细胞,然后应用 µEIS 微流控技术用 100 µM 恩杂鲁胺进行药物处理,通过阻抗测量监测细胞死亡过程(图E)。
© 2025. All Rights Reserved. 苏ICP备2022036544号-1