微流控自由流电泳具有多种优势,如缩短样品停留时间、加快分离速度、节约成本、便于携带、可集成多个操作单元、高纵横比便于快速散热和设置高电场强度,以及在具有微米级特征尺寸的通道中增强层流状态。
生物科学在很大程度上依赖于蛋白质、肽和氨基酸的鉴定和分离,而电泳进样可实现高效分离,样品稀释程度低。
1. 电泳
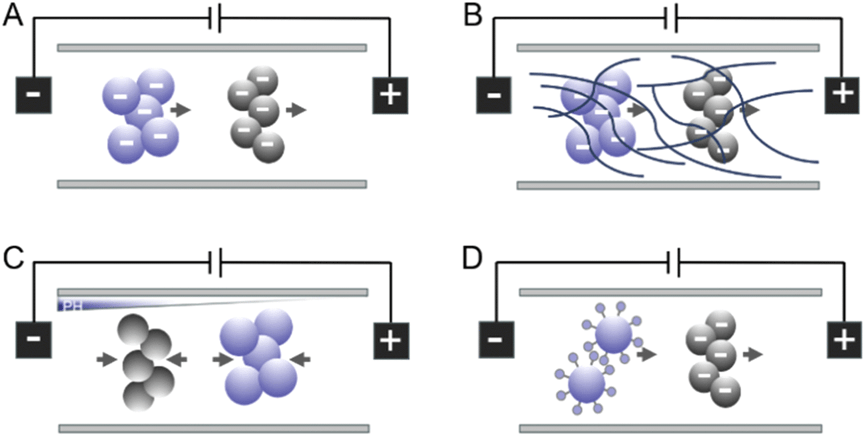
电泳是指在外部电场的影响下,带电表面及其附着物质相对于静止液体的运动。
这种运动是由粒子表面电荷所产生的库仑力引起的。
许多生物标记物的检测都是以微流控电泳技术为基础的,如激光诱导荧光(LIF)、紫外线(UV)和质谱(MS),以及毛细管区带电泳(CZE)、毛细管凝胶电泳(CGE)、等渗电泳(ITP)、胶束电动色谱(MEKC)和等电聚焦(IEF)。
下图描述了电泳模型的一些基本原理。
1) 毛细管电泳
有别于其他电泳技术,毛细管电泳(CE)采用的分离介质是熔融石英毛细管。
由于毛细管电泳分离效率高、试剂和样品消耗少、分析时间短,因此成为生物学和医学领域中一种有效的微分析平台。
毛细管电泳还与许多检测方法兼容,如吸光度法、激光诱导荧光法、质谱法和伏安法。
广泛用于控制缓冲液流量和处理样品溶质,如样品注入、分离、混合、稀释/浓缩和反应。
CE的高通量特性适用于分离各种分析物,典型应用包括片段大小估计、SSCP或RFLP分析和DNA测序。
不足之处在于使用CE分离蛋白质会出现毛细管壁吸附、涂层不稳定以及难以控制电渗流(EOF)等情况。
蛋白质吸附会导致迁移持续时间缩短、检测响应降低、重现性差、分辨率降低和分离效率下降。
不可再现的电渗流(EOF)可能会影响分离蛋白质的分辨率和可重复性。
为了减少蛋白质的非特异性附着,需要进行表面处理。
由于毛细管电泳没有移动部件、无脉冲泵、可快速分离少量样品,CE经常被用于涉及DNA的生物应用中。
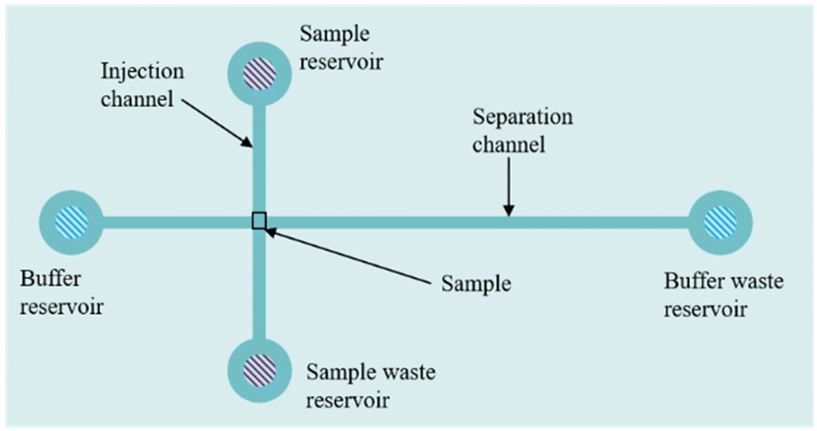
用于分离和检测DNA/RNA的常见CE芯片布局如图所示。
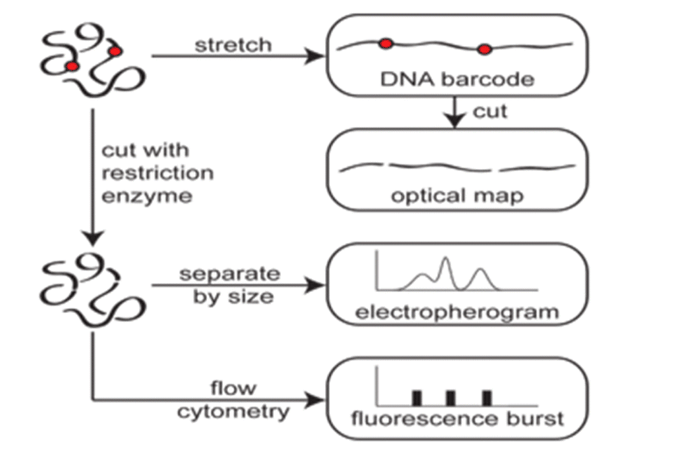
毛细管电泳技术不仅可用于DNA分离,还可用于RNA分离。
2) 凝胶电泳
凝胶电泳用于化合物分离,可采用毛细管凝胶或板块凝胶形式,也可采用各种形式的亲和层析。
在凝胶电泳过程中,电场会推动带有微孔的凝胶基质,从而分离分子。凝胶电泳可以减少扩散,扩大分离区域,因为凝胶基质会吸附在微通道壁上,中和表面电荷。
凝胶电泳常用的两种介质是聚丙烯酰胺和琼脂糖。琼脂糖形成的物理凝胶通常用于分离较长的DNA,而聚丙烯酰胺凝胶是化学交联的,用于分离较短的双链和单链DNA。
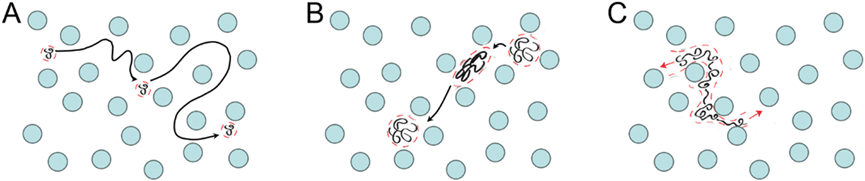
DNA分子在凝胶电泳过程中的迁移率受多种因素影响。
例如,当DNA分子小于凝胶孔径时,会发生奥格斯通筛分(图A)。
当DNA的大小接近(图B)或超过凝胶孔径(图C)时,它就会在凝胶中反转或拉伸变形。
利用这些不同的筛分模式可优化基于凝胶的分离,从而分辨给定样品中的特定粒度范围。
一般来说,凝胶电泳的优点在于能将所有过程整合到一个芯片上,包括细胞分拣、细胞裂解、提取相关物质(如DNA)、纯化、分离和分析DNA。
微尺度通道中的凝胶区甚至有助于从噬菌体以及MCF-7细胞和SKBR3细胞中提取DNA。
缺陷是:在分离过程中,分离参数无法改变或优化;明显的剪切力效应会影响分析物的完整性和功能;样品洗脱和后处理可能具有挑战性,甚至可能需要使用有毒或诱变试剂;过程是半定量的;分析过程可能很耗时。
3) 自由流电泳(FFE)
自由流电泳(FFE)又称无载体电泳,是一种无基质、高压电泳分离技术。
在流体动力泵送液体系统中,样品被引入载体电解质中,并在垂直于流体的电场作用下以层流状态流经通道。
目前已开发出包括自由流动区电泳和自由流动等电聚焦在内的多种技术,可用于分离DNA、细胞、蛋白质异构体、肽和纳米颗粒等多功能物质。
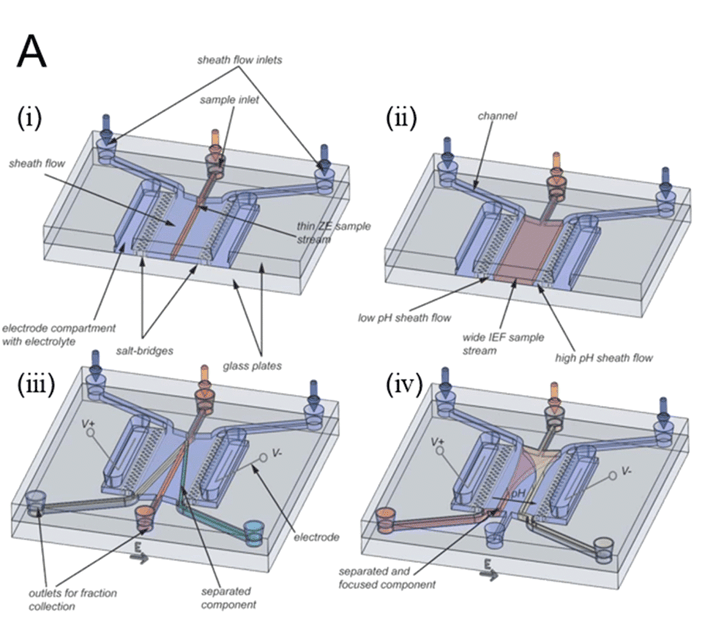
FFE的主要优点是可以快速、温和地分离溶解在液体溶剂中的样品,无需基质。
由于分析物不会附着在任何载体或基质结构上,这一特性保证了极高的回收率。
通过建立pH梯度,FFE更容易根据等电点或电荷变化定量分离样品。
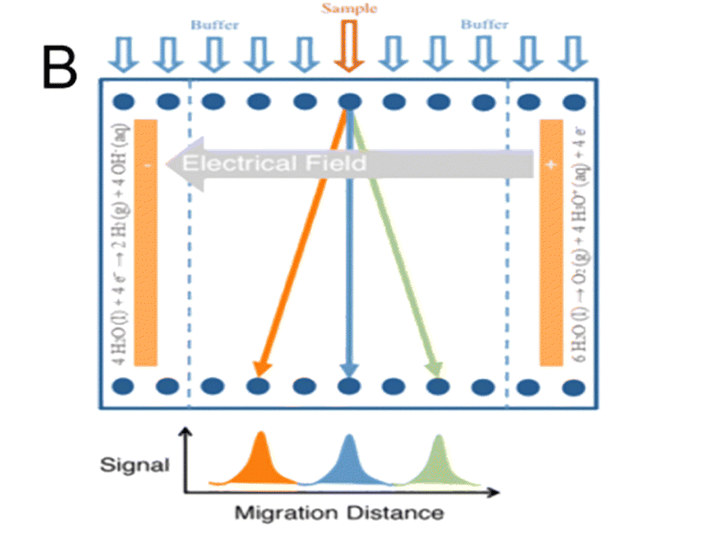
因为蛋白质样品必须按顺序而不是连续地处理,这给定量分析带来了内在的不确定性。
有研究者建议利用激光辅助化学蚀刻玻璃,然后进行电极集成和低温键合,从而在微型自由流电泳设备中实现高通量和高稳定性。
© 2025. All Rights Reserved. 苏ICP备2022036544号-1















