1. 基于微流控芯片的细胞分选及捕获
传统分离方法包括连续稀释法、荧光激活细胞分选术(FACS)、激光捕获法(LCM)和免疫磁珠分离法(MACS)等。
这些传统的商业化细胞分选及捕获技术目前在应用中处于主流地位,但是它们仍存在着较为显著的局限性,包括连续稀释法中可能出现的人为误差和物料损失;FACS、LCM、以及MACS方法涉及到的高昂的设备成本、试剂成本、有限的通量等。
微流控技术中涉及到的细胞分选及捕获的方法可以分为两大类,以细胞尺寸大小、形状、变形量等为基础参数的被动式分选方法;和基于光、电、声、磁等物理场力及相应细胞特定性质的主动式分选方法。
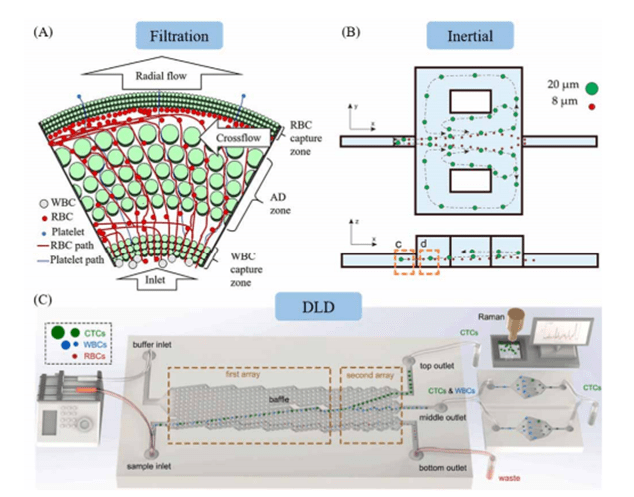
下图所示为常见的三种被动式细胞分选方式,分别是微过滤(Filtration)方法、惯性(Inertial)分离方法、以及基于确定性侧向位移(DLD)的细胞分选方法。
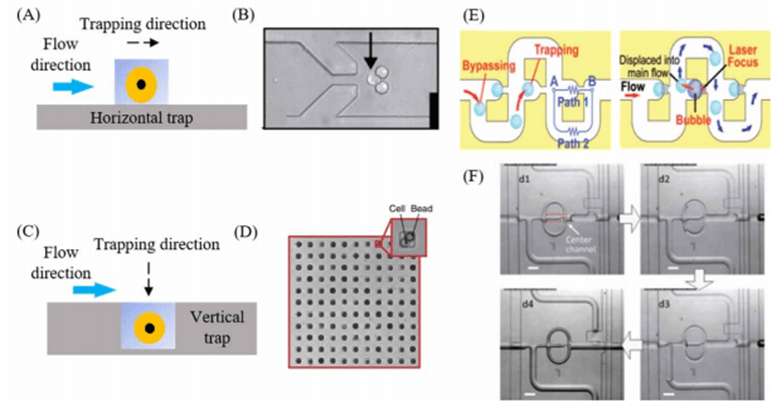
微流控技术中的单细胞捕获方法可分为:基于微结构及流体动力的方法、基于液滴包裹的方法、以及基于其他物理场力的捕获方法。
基于微结构的单细胞捕获方法是通过在微流控芯片中制造与单个细胞尺寸接近的微型捕获结构来实现的。
通过将该结构与微流道相结合,可以自动捕获流动样品中的细胞。
根据微流道中细胞的捕获方向,基于微结构的单细胞捕获方法可以分为两种类型:水平陷阱(微柱)和垂直陷阱(微坑)。
基于流体动力的捕获是通过流体动力及微观结构的配合来捕获单个细胞的。
对于流体动力捕获,细胞捕获是通过精心设计的流体通道进行精细的流量控制来实现的。
例如,在连续流体动力通道中,当单个细胞被微观结构捕获时,随后的细胞将自动切换到旁路流体通道中,直到遇到下一个空的捕获陷阱位置,直至所有的细胞被捕获在微流道中。
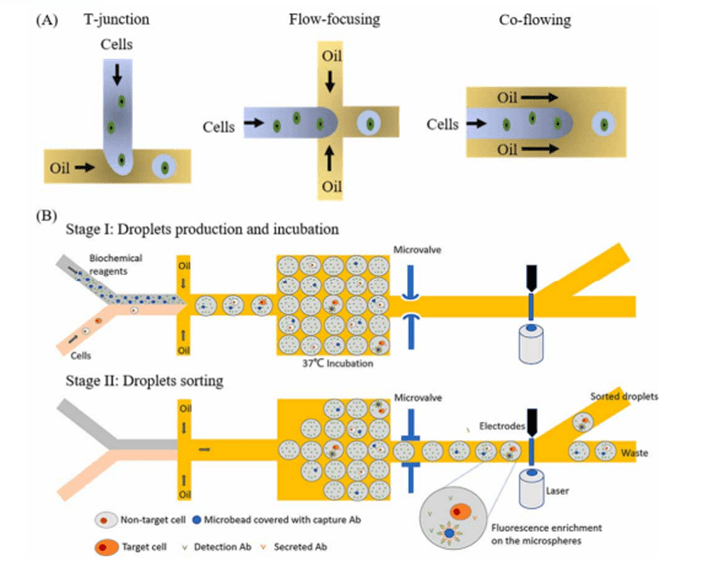
当两种不相容的流体在特定流速条件下相互作用,且细胞悬浮液受到油相液体的剪切作用时,含有细胞的液体会被油相包裹,从而形成独立的单细胞液滴。
通过精确设计液滴尺寸和优化流体的流速,能够高效地生成大量的单细胞液滴,进而实现高通量分析。
基于液滴的细胞捕获有三种典型模式。
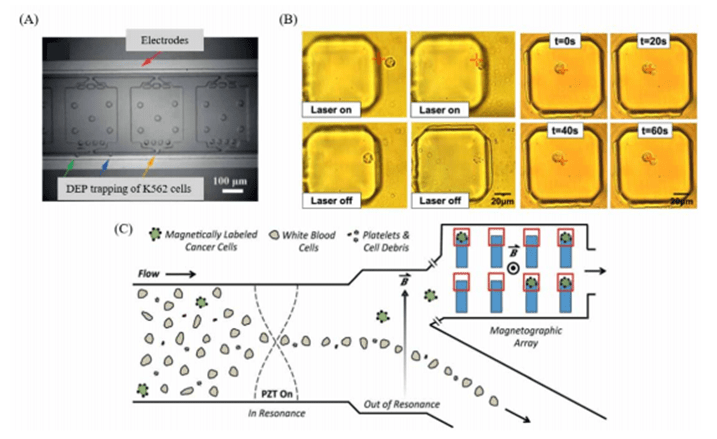
利用电场力、磁场力等外加物理场力来进行单细胞捕获具有无标记、无接触细胞捕获技术的天然优势。
通过利用MEMS制造工艺,可以在微流控芯片内部构造微电极,并通过外加电场信号在芯片内部创造不均匀电场来实现对微粒的确定性位移控制,这种电场力被称作介电泳力(DEP)。
介电泳力一般被用来进行高通量的单细胞操纵、以及目标细胞的生物物理特征的检测与分析。
2. 基于微流控芯片的单细胞分析技术
1) 荧光检测
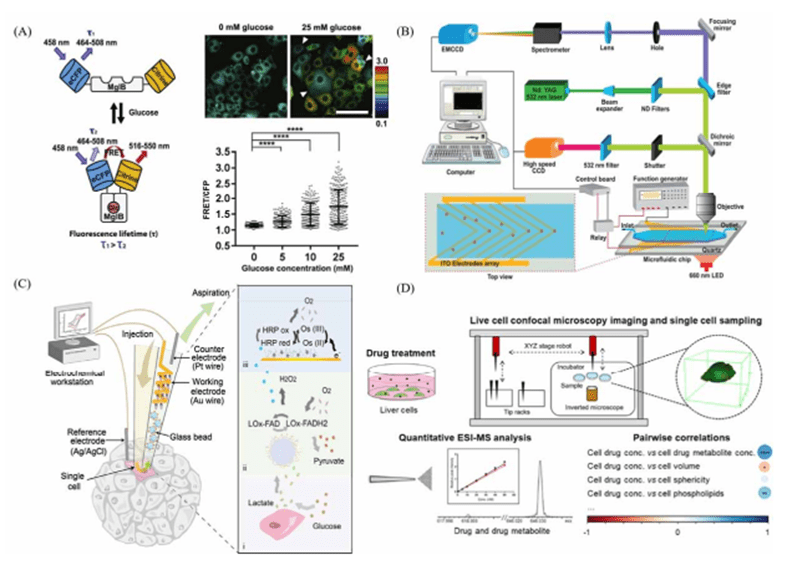
荧光检测利用激发光照射细胞使荧光探针标记的目标分析物发光,用于目标分析物的识别与定量分析。
荧光检测具有灵敏度高、选择性强、空间分辨率高以及能够实时成像等特点。
又因微流控芯片材料良好的透光性利于观察荧光信号,荧光检测被广泛用于基于微流控芯片的单细胞分析研究。
2) 电化学检测
电化学检测是利用分析物在电极表面发生电化学反应产生的电信号对分析物进行定量检测的常用方法,可以连续检测具有电化学活性的物质。
它具有灵敏度高、选择性高、时空分辨率高等特点,易于与微流控芯片集成。
微电极可以被容易地集成在微流控通道内,再结合微流控技术对单细胞强大的操控和定位能力,可以实现对目标细胞的分析。
与荧光成像相比,电化学检测不需要额外的荧光探针,减少了对细胞正常生理活动的影响。
3) 质谱检测
质谱作为单细胞蛋白质组学、代谢组学和脂质组学的重要研究工具,具有高选择性和灵敏度,且可同时检测多种物质而无需标记。
结合微流控技术进行单细胞排序或形成单细胞阵列,质谱检测可以实现对单细胞的高通量分析。
为了满足不同的检测需求,多种离子化方法被用于单细胞分析,包括电喷雾质谱(ESI-MS)、基质辅助激光解吸质谱(MALDI-MS)、二次离子质谱(SIMS)和电感耦合等离子体质谱(ICP-MS)等。
4) 拉曼检测
拉曼检测是一种无标记、非侵入性的检测技术,它通过激光激发拉曼散射信号,获取细胞内分子的振动光谱信息,从而实现对单细胞内组分的定性及定量分析,并可据此进行细胞分选。
与微流控技术结合可以克服拉曼检测信号弱和通量低的不足。最新技术是使用表面增强拉曼散射(SERS),利用纳米结构金属表面对拉曼信号的等离子增强效应,实现对细胞微量代谢物的高灵敏度检测。
© 2025. All Rights Reserved. 苏ICP备2022036544号-1















