研究者设计了一种基于声表面波的微流控芯片,用于细胞内RNA的快速提取和检测。
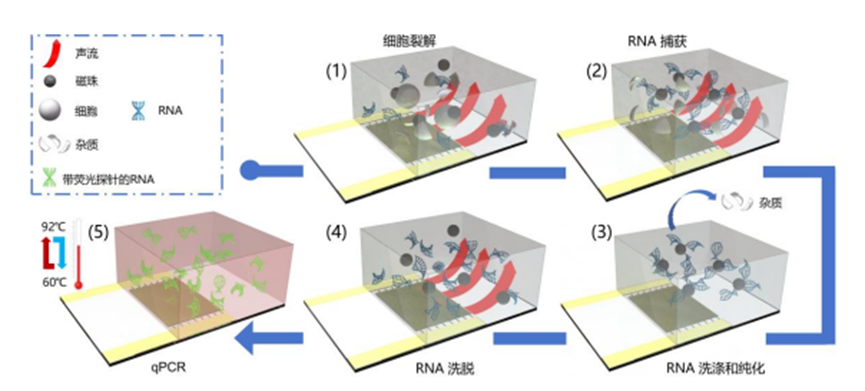
该芯片使用声表面波在一个微型腔室内实现了检测全流程,包括细胞裂解、RNA捕获、RNA洗涤纯化、RNA洗脱以及qPCR。
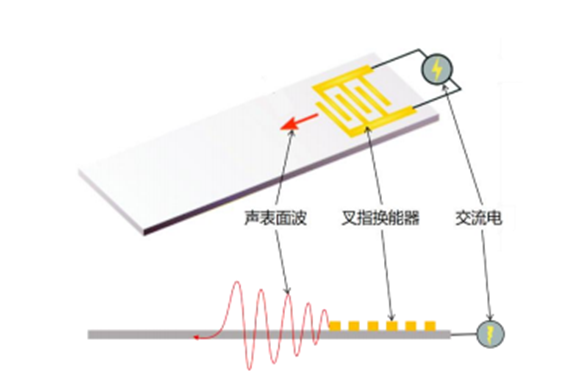
1. 声表面波
声表面波是一种在压电材料表面传播的声波。
通过射频范围内的交流电驱动压电材料表面上的叉指换能器(IDT),可以在压电晶体上直接产生特定波长的声表面波。
由于其操作简单,声表面波通常与芯片实验室和微流控芯片集成。
由于声表面波独特的多功能性、非侵入性和生物相容性,使基于声表面波的微型设备广泛应用于生物和化学分析等生物医学领域研究。
2. 声表面波核酸检测的原理
当表面波到达基底和水的界面时,由于传输速度差,表面波折射到液体中,其折射角被称为瑞利角。
这种现象会在液体内部引起机械冲击,使得声能与液体耦合产生高速流动,进而导致液体内物质的快速碰撞以及不同物质之间的能量转移。
因此,将磁珠引入细胞溶液可以通过磁珠和细胞之间的声表面波诱导的快速和高频碰撞来实现细胞裂解。
此外,声表面波诱导的拖拽力可促进磁珠悬浮,进而提高磁珠与RNA的接触表面积,从而提高RNA与磁珠的结合效率。
声表面波还能诱导液体产生高速涡流,以此可提高RNA洗脱效率。
通过利用声表面波诱导的机械冲击和热效应,以及微流控通道的流体控制,文中提出了一种声表面波微流控芯片来执行细胞内RNA检测的所有步骤。
3. 叉指换能器的设计与制作
1) 叉指换能器的特性
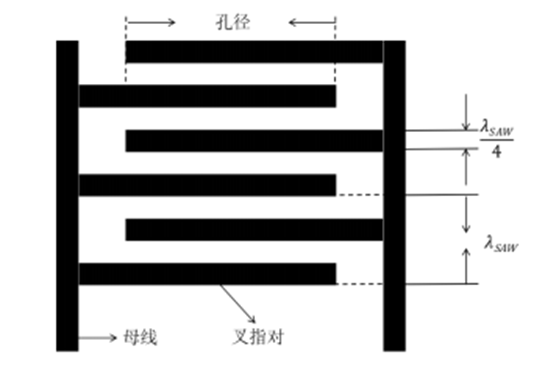
这种结构在换能器叉指对之间产生了一系列交替方向的电场,进而通过逆压电效应,在压电基底中产生了压缩和拉伸应变的交替区域。
因此,每对叉指均在基板中产生偏移,并随电场振荡并产生声表面波。
叉指对的周期性决定了声表面波的波长(𝜆),由此两个叉指之间的距离定义为𝜆/4。
表面波速取决于压电基底的性质、声表面波传播方向和压电基底的厚度。
而IDT的中心频率(𝑓)则是由压电基底的材质、声波的传播方向和IDT设计结构决定的。
另外,IDT必须在正确结构和参数下才能提供最佳的声表面波效果,因为有几个重要参数会影响到声表面波器件的性能,例如波长、孔径、叉指对数的数量和IDT结构。
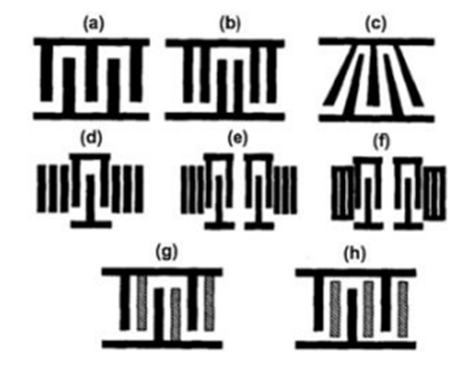
IDT的结构设计也是影响声表面波传播的重要因素之一,下图展示了几种常用的IDT设计。
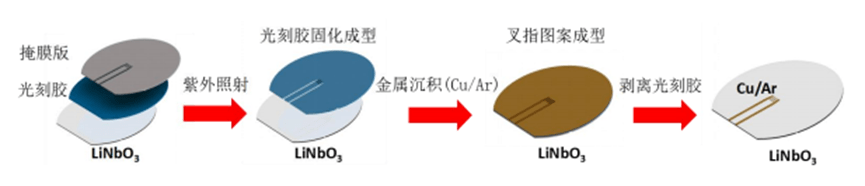
2) 叉指换能器的加工
一般而言,制作叉指电极的材料可以分为:铜(Cu)、铝(Al)、银(Ag)和金(Au)。
其中铜和银在施加电信号时会发生氧化,铝电极在施加电信号后则会在液体中发生化学反应,因此这三种材料都不适合用作叉指电极的主要材料。
文中选择金作为叉指电极的主要材料,由于金在重复使用时容易发生脱落和磨损,从而影响声表面波的作用。
因此为了解决金与压电基底表面粘附力不强的问题,在制备金电极之前先在压电基底表面上附加了镍(Ni)和钛(Ti)以提高粘附力。
对于使用过程中的表面摩擦对叉指电极产生的磨损问题,则选择在电极表面镀上氧化硅(SiO2)薄膜用于保护叉指电极。
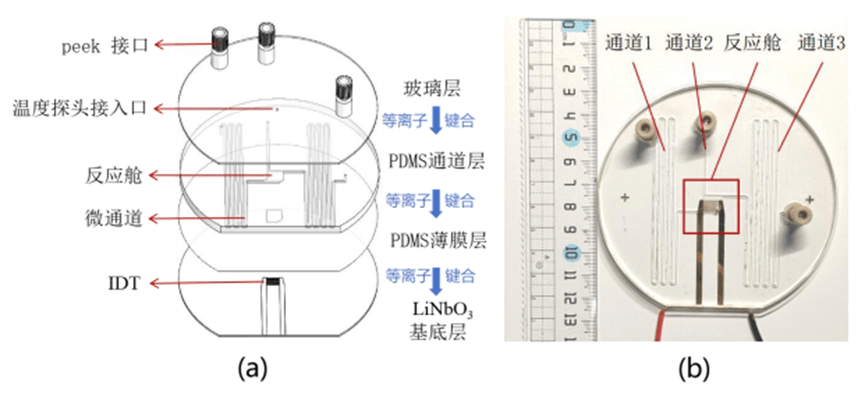
4. 微流控检测芯片构造
微流控芯片由四层组成,包括玻璃层、聚二甲基硅氧烷(PDMS)通道层、PDMS薄膜层以及铌酸锂基底层。
顶部为玻璃层,包括了3个由直径1mm的孔构成的peek接口,用于试剂的注射和废液的排出,以及一个温度探头接入口。
第二层为PDMS通道层,该层由PDMS制成,设计有容纳各种生化反应的反应舱和用于预储存各种试剂的微流控通道。
第三层为PDMS薄膜层,该层由100μm厚的PDMS薄膜制成,它用于密封第二层的微通道以避免试剂在转移过程中泄露。
PDMS薄膜中间部分按照反应舱尺寸做镂空处理,以便完全贴合反应舱。
该设计是为了保证声表面波能量可以有效地进入反应舱。
底层为LiNbO3基底层,该层加工有IDT,负责产生反应过程中所需的声表面波。
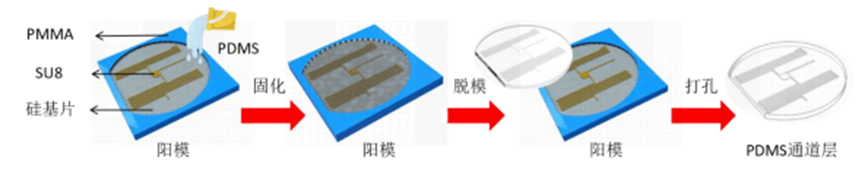
PDMS通道层是通过向聚甲基丙烯酸甲酯(PMMA)材质的阳模浇筑PDMS成型制作的。
文中重点分析了不同参数和结构的IDT对细胞裂解的影响,为基于声表面波细胞裂解的IDT提供了较全面的设计指南。
对微流控芯片中的RNA捕获及RNA洗脱步骤进行了分析,结合了有限元仿真、理论计算以及显微成像实验,直观的展示了声表面波诱导的磁珠悬浮以及验证了该现象在本文的微流控核酸检测芯片中的可行性。
同时,通过共聚焦荧光染色实验,证实了声表面波诱导的磁珠悬浮可显著提高磁珠对RNA的捕获效率。
通过搭建闭环温度控制系统,实现了基于声表面波微流控芯片反应舱内的温度实时检测-PID控制-信号输出控制的快速响应的温度精确调控。
最后对整个实验平台进行了搭建,详细的介绍了声表面波微流控病毒检测芯片的自动检测流程。
用3种不同的假病毒来模拟RNA病毒对宿主细胞的感染,并在该芯片上完整的完成了从“样本到答案”的核酸检测过程,成功提取并扩增了宿主细胞中的假病毒RNA。
参考文献:[1]杨宇鹏.基于声表面波的一体化核酸提取检测微流控芯片[D].济南大学,2024.
© 2025. All Rights Reserved. 苏ICP备2022036544号-1















