1. 传统的细胞分选技术
1) 密度梯度离心法
该方法基于细胞在不同密度梯度中的沉降速度差异,通过调整密度梯度,使得目标细胞在特定密度层次中沉淀,从而实现对其的有效分离。
密度梯度离心法简单易行,无需复杂的设备,适用于大规模的样本处理。
但可能导致细胞失活、损伤或交叉感染,同时对于罕见的循环肿瘤细胞,无法通过离心形成特定的区带,分离的效率极低。
2) 荧光激活细胞分选法
荧光激活细胞分选技术(FACS)原理是首先将待分选细胞与荧光探针偶联的特异性单克隆抗体进行标记。
之后,在流式细胞仪中,细胞在鞘液的作用下被水化成单个细胞液滴。
当带有荧光标记的细胞液滴经过激光检测区时,根据其发出的荧光信号强度,通过施加不同电荷将其与未标记细胞液滴分离开来。
最终,带正电荷的细胞液滴在电场作用下发生偏转,被分选收集到不同的管道中。
FACS 技术分选纯度高、处理效率快且可实现多参数分选。
不足之处在于:1)昂贵的仪器设备和试剂成本;2)复杂的操作流程,需专业人员进行参数优化;3)对细胞活性可能产生一定损伤;4)对于极低浓度样本,分选效率会大幅降低。
2. 微流控细胞分选技术
1) 惯性微流控分选
惯性微流控分选是一种基于微流控技术的高通量细胞分选方法,其主要依赖于微流体的惯性效应来影响细胞或者粒子的迁移。
当细胞在微流控直流道内流动时,受到壁面迁移力和惯性迁移力的共同作用。
壁面迁移力使细胞远离壁面;而惯性迁移力则促使细胞聚焦于特定位置。两种力的平衡导致了不同尺寸粒子在流道中的分离。

2) 电学微流控分选
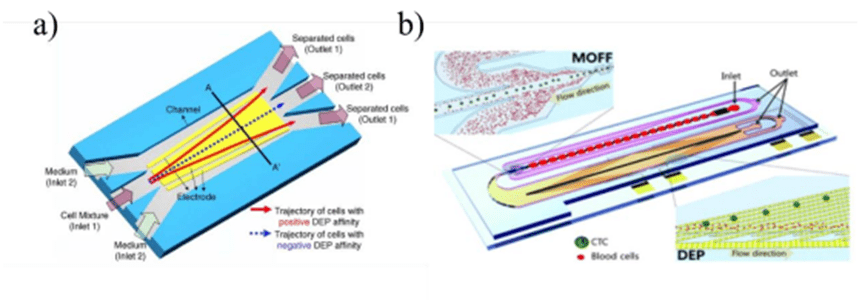
电学分选主要为介电泳分离(DEP)。介电泳是依据细胞的固有介电特性(即极化率)来实现分离。
其原理是在非均匀电场下,产生电场梯度。
电场会在细胞内外形成极化效应,产生不平衡的库仑力,即介电泳力(DEP 力)。
介电泳力的大小和方向取决于细胞与介质之间介电特性(介电常数和电导率)的差异、电场频率以及电场梯度分布。
正向 DEP 力将粒子从低电场区域吸引到高电场区域,而负向 DEP 力则将粒子从高电场区域排斥到低电场区域。
3) 磁性激活分选细胞
在磁性微流控分选中,微流控芯片通常包括具有微流道和磁性材料的微结构。
首先,目标细胞被标记上磁性颗粒,这些磁性颗粒可以是磁性微珠或磁性纳米颗粒,通过表面特异性配体与目标细胞的特定受体结合。
然后,细胞悬浮液被注入微流道中,外部磁场被应用于微流控芯片上,使得带有磁性标记的细胞受到磁场力的作用,从而沿着特定方向移动或聚集。
最后,通过微流控结构将目标细胞分离出来,完成细胞分选的过程。

利用磁性激活细胞分选技术的优势在于其高度的选择性和灵活性,该方法无需昂贵的设备,操作相对简便,易于掌握。
缺陷在于:1)在结合和分离过程中可能会对细胞造成机械损伤,同时存在非特异性吸附的问题;2)在多次冲洗步骤中,循环肿瘤细胞的损失风险较高,会降低分离的效率;3)标记精准性严重依赖于抗原抗体结合的特异性。
4) 声波微流控分选
声波微流控分选技术利用声波场对细胞施加力的原理,使得不同类型的细胞在流体中产生不同的运动行为,从而实现对细胞的分离和分选。
当细胞悬浮液通过微流道时,声波场会对其中的细胞施加力,推动细胞在流体中产生不同的运动。
通过合理设计微流道的结构和声波参数,可以实现对目标细胞的精确分选。
例如,可以通过调节声波频率、幅度和流速等参数来控制细胞的运动轨迹,从而实现对细胞的分离和分选。

5) 光学分选技术
光学捕获法是由会聚的强激光束形成的光学陷阱,是一种选择捕获单细胞的非接触方法。
光学捕获通常与微流控系统结合使用,以极高的精度操纵空间中的细胞,迫使单个细胞靠近激光束的焦点以捕获它们。
具有微米级定位能力的光学陷阱与微流控芯片高度兼容,但捕获细胞没有表现出特别不同的折射率,细胞必须无荧光标记和使用传感器控制。
由于光镊的一束一阱特性及设备的成本高昂,使其成为一种低通量工具,无法广泛应用。
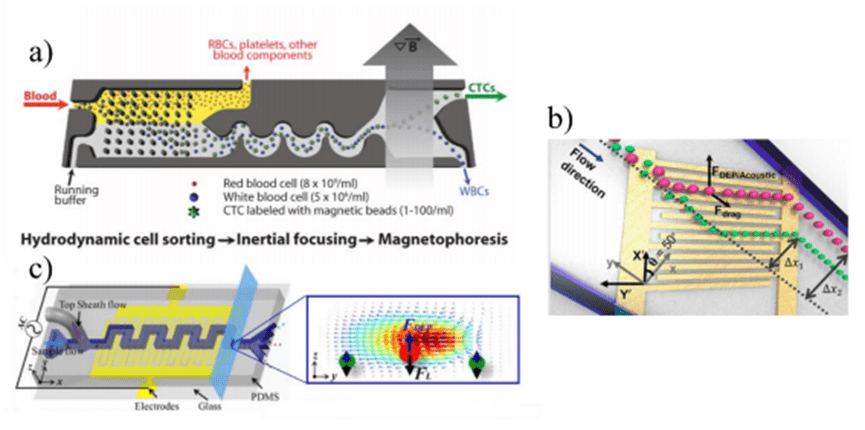
6) 多级微流控分选
单一的微流控技术由于其作用原理和分离机制的局限性,往往无法完美地将细胞从复杂的血液样本中分离出来。
例如,基于细胞尺寸差异的微流控分选技术就无法很好地区分尺寸相近的白细胞和 CTCs。
集成多种不同的分选技术可以提高分离效率和纯度,利用细胞在尺寸、密度、表面标记物、电荷、变形性等多种物理化学特性上的差异,通过耦合不同的分离机制来实现对细胞的高效分选。
© 2025. All Rights Reserved. 苏ICP备2022036544号-1















