核酸扩增技术(NAT)是一种关键的分子生物学方法,能够检测微量靶标,主要分为变温和恒温两种类型。
变温检测方法以聚合酶链式反应(PCR)为代表,包括传统PCR和荧光PCR等。
PCR通过反复升降温来实现核酸扩增,广泛应用于基因诊断、病原检测和基因表达分析。
然而,PCR对设备和操作条件要求较高,在资源匮乏的环境中使用受限。
相对而言,恒温检测方法无需复杂的温控设备,可以在恒定温度下进行扩增。
常见的恒温扩增技术有环介导等温扩增(LAMP)、重组酶聚合扩增(RPA)和核酸序列依赖变性扩增(NASBA)等。
其中,LAMP因其高灵敏度、特异性、快速性和简便性,成为恒温扩增技术的代表。
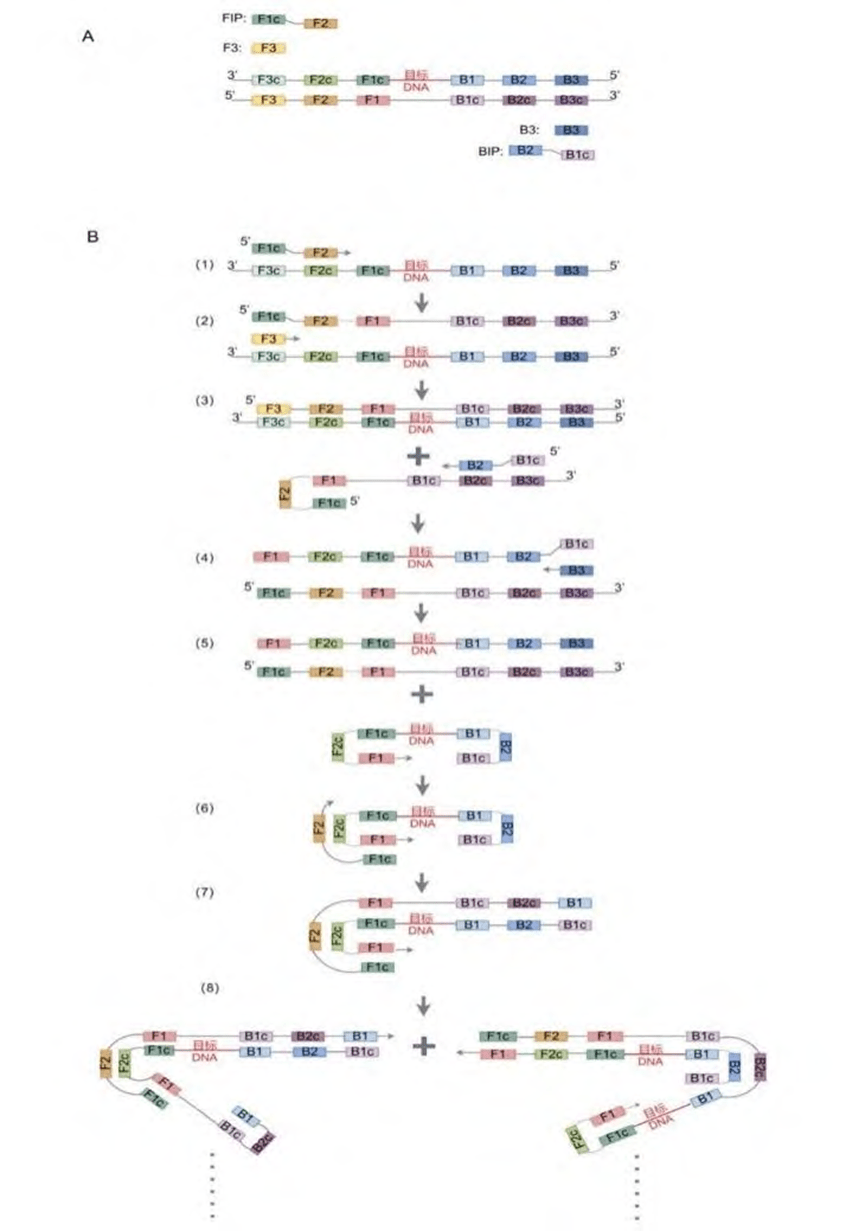
1. LAMP原理
LAMP技术的原理是在65℃左右的恒温下,通过设计4个引物(两个内引物:上游内引物FIP、下游内引物BIP;两个外引物:上游外引物F3、下游外引物B3),来识别靶基因的6个特定区域。
BstDNA聚合酶具有链置换活性和聚合功能,在其作用下,引物与靶基因序列结合形成哑铃状结构的单链DNA,作为模板进行指数扩增。
最终,形成具有多茎环状和花椰菜结构的目标产物,整个扩增过程通常在30~60分钟内完成,将目标基因扩增至10^9至10^10倍。
2. LAMP技术优点
1) 高效性
LAMP扩增反应不需要PCR的DNA变性过程,且反应以多起点同时扩增,使整个LAMP技术仅需30~60min即可完成目标基因109的指数型扩增。
通过引入环引物以及优化反应体系,例如内外引物浓度比、酶浓度和镁离子浓度等,可以加快LAMP反应的扩增速率,从而大幅缩短检测所需时间。
2) 特异性
LAMP反应使用4到6种引物(包括内引物FIP、BIP,外引物F3、B3,以及可选的环状引物LF、LB),这些引物能识别目标核酸的6到8个独特位点。
这使得LAMP在特异性上优于传统的PCR方法,从而提高了检测的准确性。
研究表明,LAMP检测具有很高的特异性,能够精确识别目标病原体或遗传物质,避免与其他病毒或病原体的交叉反应。
3) 灵敏性
LAMP反应在恒温条件下进行,每个引物都可以连续地诱导DNA的扩增,因此在反应过程中会产生大量的扩增产物,这使得即使起始目标序列浓度很低,也能产生足够的扩增产物,从而提高了检测的灵敏度。
4) 简便性
LAMP仅需在如水浴锅、保温杯、加热块等能提供恒温条件的设备下即可实现扩增,无需热循环仪等专业设备;且扩增产物易检,通过肉眼观察产生的沉淀或使用离子指示剂观察反应液颜色的变化等方式即可判断检测结果。
并且,LAMP反应体系简单,只需核酸模板、引物、DNA聚合酶及反应缓冲液等基本组分,无需复杂的试剂和操作,从而简化了实验步骤。
3. 产物检测方法
1) 基于反应终点的产物检测
a) 凝胶电泳法
凝胶电泳法是最常见的LAMP产物检测方法,其原理与普通PCR产物电泳原理相同。
在4~6个特异性引物识别靶序列后扩增形成的LAMP产物呈现多茎环状和花椰菜状,导致经凝胶电泳的阳性LAMP产物呈梯形条带,但由于此方法需要凝胶成像显示仪、耗时较长,且需开盖检测,存在交叉污染风险。
b) 离子指示剂法
LAMP反应过程中,大量焦磷酸根离子从脱氧核糖核苷酸三磷酸(dNTPs)中释放,与反应体系中的镁离子结合产生大量的焦磷酸镁作为副产物,肉眼观察为白色浑浊,这种判断方法存在一定的主观性,且依赖于检测人员的经验。
c) pH指示剂法
LAMP反应开始扩增时,会产生大量的焦磷酸盐和氢离子,导致反应液的pH值下降,由中性转变为酸性。
为检测LAMP的扩增产物,可选用酚红、甲酚红、中性红等作为指示剂。
d) 横向流动试纸条检测
横向流动试纸条(LFD)技术将聚合酶链反应、抗原抗体结合反应、免疫层析技术和分子生物学技术有机结合,使检测具有高特异性、高灵敏性及即时检测性。
LFD用于检测LAMP扩增产物全过程仅需5~15min,且检测限高达5pgDNA,此方法基于序列间特异性扩增,进一步提高了反应的灵敏性和特异性,且检测速度快。
2) 基于反应实时检测
a) 浊度分析仪实时检测
通过浊度仪检测LAMP产物,不仅能实现反应观察,还能定量测量反应液中微量的核酸。
荧光染料在特异性掺入双链DNA后会增强荧光信号,因此可通过检测荧光信号强度来定性指示双链DNA的数量。
b) 荧光法实时检测
与其他产物检测方法相比,尽管实时荧光LAMP具有灵敏度高、实时检测等优点,但其原理是基于反应液内的离子变化。
因此,当荧光强度增强时,焦磷酸镁沉淀物也会增加,可能会出现沉淀物掩盖荧光的情况,导致检测结果不准确。
4. 新型LAMP
1) 免疫磁分离环介导等温扩增技术(IMS-LAMP)
免疫磁分离(IMS)技术通过将特异性抗体偶联到磁性粒子表面,形成磁性粒子-抗体复合物。
当该复合物与样品中的目标微生物发生抗原抗体反应时,便能形成病原体-抗体-磁珠复合物。
在磁场作用下,该复合物可以被定向移动,从而与其他杂质分离,直接从复杂样本或增菌液中分离和富集目标微生物。
IMS-LAMP结合了免疫磁分离和LAMP技术,先用IMS进行目标微生物的分离和富集,再通过LAMP进行检测。
此方法能够有效去除样品中的酶抑制剂,提高检测灵敏度,并缩短病原体富集所需的时间。
2) LAMP与CRISPR/Cas系统的联用
CRISPR/Cas系统由单链向导RNA(gRNA)和Cas蛋白组成,gRNA与靶序列互补,从而引导Cas蛋白进行特异性识别和切割。
将CRISPR/Cas系统与LAMP技术结合,形成了一种新型的病原体核酸扩增检测方法。
CRISPR/Cas系统具有可设计的gRNA和可使用的报告基团,通过这两种技术的联用,可以有效克服LAMP扩增中因引物设计不当、核酸产物污染或反应体系不理想而导致的特异性和灵敏度下降问题。
3) LAMP与Argonaute系统的联用
Argonaute蛋白根据来源分为真核和原核两种。
真核Argonaute蛋白主要参与RNA干扰(RNAi),通过与小RNA分子结合形成复合物,识别并切割或抑制特定RNA,从而调控基因表达。
原核Argonaute蛋白则主要用于宿主的防御机制,结合引导DNA或RNA,识别并切割外源性DNA或RNA,保护细胞免受病毒和质粒等外来核酸的侵害。
4) LAMP传感器
生物传感器是一种能够检测生物分子或生物事件的装置,其原理是利用生物识别元素(如抗体、酶、DNA探针等)与传感器表面相互作用,产生信号变化。
当目标生物分子存在时,生物识别元素与之结合,引发传感器输出信号的变化,从而实现对生物分子的检测。
5) LAMP与微流控芯片结合
与传统LAMP相比,LAMP与微流控芯片结合,具有以下优势:
1)可以实现一体化的样品处理、扩增和检测,不仅简化了实验流程,还减少了假阳性的可能;
2)微流控芯片通常可以处理微升至纳升级别的样品量,结合LAMP技术,可以在小样本量下进行高效的扩增和检测,适用于微量或稀缺样品的扩增和检测;
3)微流控芯片具有体积小、易携带、检测时间短等优势,于LAMP技术结合,可更好地适用于野外、医疗点和资源匮乏地区的现场快速检测。
© 2025. All Rights Reserved. 苏ICP备2022036544号-1













