液滴、颗粒和胶囊是活性物质、治疗药物和组织细胞的优良载体,广泛应用于生物医药、食品和化妆品等领域。
例如,胶囊能够包裹益生菌、维生素等活性物质,实现密封保存和可控释放。存储期间,胶囊能保护活性物质免受光照和氧气等不利因素的影响,提升其稳定性和存储时间。
应用时,胶囊可以通过扩散等方式缓慢释放活性物质,或通过机械挤压、壁材溶解等方式快速释放,以实现对活性物质释放的控制。
在生物医学领域,液滴、颗粒和胶囊作为药物的新型载体,可以控制药物释放,减少毒副作用。
例如,抗癌药物通常具有细胞毒性,快速释放可能导致浓度过高,损伤正常细胞。通过液滴、颗粒或胶囊控制药物缓慢释放,可以降低毒副作用,实现高效递送。
微流控技术能够精确控制流体,从而控制乳化过程,制备大小可控、尺寸均一、结构可调的液滴。以液滴为模板,可以进一步制备大小可控、尺寸均一、结构可调的颗粒和胶囊。
微流控可控制备液滴及其应用
传统釜式搅拌法缺乏对乳化过程的控制,导致制备的液滴大小不均。微流控技术通过在微通道中精确控制剪切过程,制备大小可控、尺寸均一和结构可调的液滴。
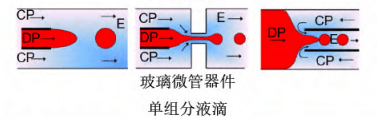
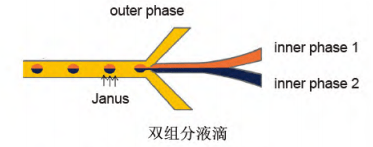
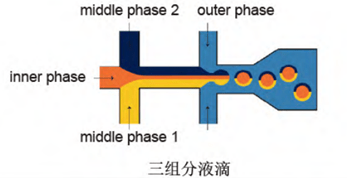
在连续相的剪切作用下,分散相形成尺寸均一的液滴,这些液滴可以包含单组分、双组分或三组分等形式。
常见的PDMS微流控器件包括T型、十字型和Y型。PDMS微流控器件的优点是生物相容性好,并且可以设计复杂的通道结构。
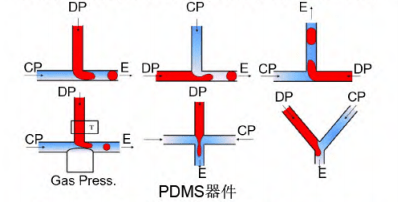
然而,其缺点是溶剂抗性较低,可能导致PDMS溶胀。此外,二维通道结构不利于流体剪切乳化。
以制备油包水单乳液滴的PDMS微流控器件为例,需要确保连续相油相能够很好地润湿通道表面,因此必须对通道表面进行疏水处理。
微流控技术在食品领域有广泛应用,如制备蛋白乳液。
利用PDMS微流控器件,可以将葵花籽油乳化成尺寸均一的油滴,并通过大豆蛋白吸附在油/水界面,增强油滴的稳定性,从而构建分散尺寸均一的葵花籽油滴大豆蛋白食品乳液。
微流控技术能够精确控制液滴的尺寸和结构,而3D打印技术则能精确控制液滴的空间排列。
将微流控技术与3D打印结合,形成微流控3D液滴打印技术,可以实现液滴阵列的可控制备。
改装的3D打印装置利用3D打印平台控制微流体,微流控和微流控3D液滴打印均能制备悬浮液滴,应用于护肤品等领域。
微流控可控制备颗粒及其应用
由于微流控技术能够精确制备单乳液滴,这些乳液滴可以作为模板,通过溶剂挥发、离子交联、光交联和化学交联等方式进一步制备颗粒。
与传统的喷雾干燥和搅拌乳化方法相比,微流控制备的颗粒具有粒径可控、尺寸均一、重复性好的优点,广泛应用于食品和生物医学等领域。
在生物医学领域,水凝胶颗粒可用于封装细胞,为其提供三维微环境,广泛应用于细胞培养和组织再生。
例如,通过离子交联制备的包裹间充质干细胞的海藻酸钠水凝胶颗粒,可以保护干细胞的活力和功能,并通过微创方式实现骨缺损的干细胞递送治疗。
水凝胶颗粒不仅可以封装细胞,还能负载药物,实现可控递送。
例如,通过光交联制备的可注射水凝胶颗粒可以负载抗炎药双氯芬酸钠,通过缓慢释放实现药物在大鼠膝关节的持久作用,为关节炎治疗提供新方案。
除了溶剂挥发、离子交联和光交联外,化学交联也常用于颗粒制备。通过化学交联制备的水凝胶颗粒,可以设计颗粒间的相互作用,组装成细胞生长支架,促进细胞迁移和组织再生。
微流控可控制备胶囊及其应用
胶囊通常由壳层包裹内核,形成核壳结构。微流控技术通常以双乳液滴为模板制备胶囊。
首先,通过微流控器件制备水包油或油包水双乳液滴,然后通过溶剂挥发、离子交联、化学交联等方法,得到稳定的胶囊。
微流控器件通过精确设计通道结构,控制流体流动和剪切过程,从而制备出尺寸均一、壁厚可控、包裹率高且操作简单的胶囊。
为了应用于食品和生物医学等领域,胶囊壳层常采用生物相容性的海藻酸钠、胶原蛋白、聚乙烯醇、聚乙二醇等材料,这些材料可以延长被包裹物的存储时间并实现其可控释放。
虽然胶囊的制备通常以双乳液滴为模板,但也可以通过单乳液滴作为模板制备胶囊。这种方法通过溶剂挥发使聚合物在油/水界面沉积,形成包裹油滴的胶囊。
相比之下,双乳液滴的制备通常需要复杂的微流控器件,不易放大,而单乳液滴的制备相对简单,更易于实现高通量制备。
核壳结构的胶囊在生物医药等领域有广泛应用,其内核和壳层可以装载不同细胞,构建器官模型。
例如,以水包水双乳液滴为模板,通过钙离子交联制备海藻酸钠水凝胶胶囊,其中水相内核可以包裹肝细胞,水凝胶壳层可以包裹成纤维细胞,从而构建肝脏类器官模型,用于药物筛选等应用。
© 2025. All Rights Reserved. 苏ICP备2022036544号-1















