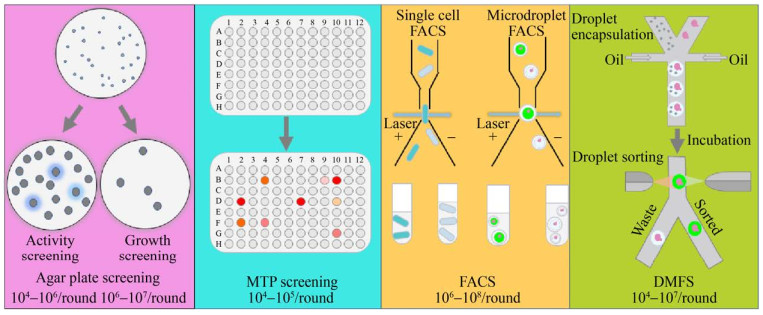
传统的琼脂平板筛选法和微孔板筛选法是目前常用的两种筛选方法。
琼脂平板筛选通过透明圈或颜色圈检测活性,或基于营养缺陷型或抗性进行生长选择,适用于初筛以排除大量无活性和低活性突变体。
然而,琼脂平板筛选法并不适用于所有改造目标,且难以准确定量。
为此,基于荧光或吸光度精确检测目标产物的微孔板 (Microtiter plate, MTP) 筛选方法应运而生,但其通量低且操作耗时。
为解决这些问题,近年来开发了荧光激活细胞分选 (FACS) 和液滴微流控分选 (DMFS) 等超高通量筛选方法。
琼脂平板筛选
琼脂平板法是一种简单直接的筛选方法,已广泛用于多种水解酶(如脂肪酶、酯酶、蛋白酶)和氧化还原酶(如漆酶)突变库的初筛中。
该方法分为表型活性筛选和表型生长选择两类。
表型活性筛选通过观察菌落周围的水解圈、颜色圈或荧光产物来检测酶活性或目标产物。
表型生长选择则是根据细胞对抗生素或其他有害物质的抗性,或通过营养缺陷型互补,在选择培养基上根据生长情况进行筛选。
然而,琼脂平板法在突变体间差异可视化方面较弱,仅适用于突变库的初步筛选。筛选后的突变体仍需通过微孔板法等其他检测方法进行准确定量。
数字影像分光光度计的应用提高了琼脂平板法的灵敏度,使其通量达到每天筛选10^5个克隆。
如果能够根据目标酶或代谢产物的特性建立琼脂平板筛选方法,就无需依赖复杂仪器设备进行超高通量筛选。
微孔板筛选
微孔板筛选方法通过检测微孔板中底物或目标产物引起的吸光度或荧光变化进行定量分析,确保筛选的精确性和灵敏度,是目前最常用的筛选方法。反应体积通常在100–200 μL,节省了试剂成本。
常用的微孔板为96孔板,兼容自动单克隆采集系统和液体自动处理系统,筛选通量可达每天10^4个克隆。
然而,机械自动化设备的引入增加了实验成本。为提高筛选通量并节省时间,384、1536、3456孔微孔板也已用于目标代谢产物和酶的筛选,同时节约了昂贵底物的使用。
尽管如此,微孔板筛选的通量仍然有限,不利于对大容量突变库的快速筛选。
荧光激活细胞分选 (FACS)
FACS(荧光激活细胞分选技术)是一种高效的单细胞分选技术,能够根据细胞大小或荧光信号以每小时高达10^7克隆的速率进行分选。
FACS还可以直接将筛选出的优势突变体分配到微孔板中进行回收与鉴定。
进行FACS筛选前,必须建立酶活性表型与其编码基因的偶联,将酶活性转化为可检测的荧光信号,并与酶所在细胞构建物理联系,确保表型与基因型一致性。
根据荧光产物与酶及其编码基因偶联形式的不同,FACS酶活性筛选体系可分为细胞膜表面展示、胞内荧光产物富集、荧光蛋白表达活性报告等类型。
对于检测胞外分泌酶或代谢产物,可将细胞包埋在水/油/水双液滴或水凝胶中,以保证基因型和表型的关联。液滴包埋技术拓宽了FACS的应用范围。
液滴微流控筛选 (DMFS)
DMFS(液滴微流控分选)方法通过在芯片上高频(>10 kHz)地将单个细胞包埋在液滴中,实现基因型与表型的偶联,并通过检测液滴内的物质信号进行定量分析与分选,筛选通量可达每小时10^5克隆。
油包水液滴提供纳升级至皮升级反应室,使此方法不仅适用于细胞内酶或代谢产物的筛选,也适用于胞外分泌酶或代谢产物的筛选。
相比于常规的微升至毫升级反应体系,DMFS缩小了反应体积百万倍以上,大大降低了试剂需求量,在使用昂贵底物或试剂时具有显著优势。
此外,单层液滴包埋后仍可进行分析试剂的注入、液滴融合、分裂等操作,提高了灵活性。
油包水单液滴再进行水相包埋后形成的水/油/水双液滴也可用FACS进行筛选,通量进一步提高到每小时10^7克隆。
利用微流控芯片形成的水凝胶微滴也可以通过FACS筛选,且水凝胶微滴稳定性高,适用于长时间细胞培养。
然而,双液滴和水凝胶在液滴形成后的后续操作(如分析试剂的注入、液滴融合、分裂等)较为困难,不利于整个筛选过程的灵活操控。
DMFS结合了精密的液滴操作和快速分选系统,已经成为定向改造胞外酶和代谢物突变库筛选的有力工具。
尽管DMFS在高通量筛选胞外产物方面具有显著优势,但其过程较复杂且技术性较强,对于初学者较难操作,且针对不同的目标产物或酶,DMFS筛选体系参数变化较大,需要进行大量系统优化。
关于我们
顶旭(苏州)微控技术有限公司是一家专注于微流控领域的高科技企业,我们致力于为客户提供微流控芯片定制、表面修饰改性、微流控芯片加工设备、以及微流控仪器等全面的微流控解决方案。公司团队拥有丰富的经验和技术积累,持续将专业知识与创新思维相结合,为客户提供高品质的解决方案。我们将始终坚持以客户为中心,不断挑战自我,不断追求卓越,通过专业、创新和合作,为客户创造更大的价值,共同开创微流控领域的美好未来。
© 2025. All Rights Reserved. 苏ICP备2022036544号-1















