微流控芯片起初的加工材料是玻璃和硅,随着微机电加工技术和毛细管电泳技 术的发展,微流控芯片的加工技术逐步改进。
直到 2000 年 Whitesides 实验室首次提出了软刻蚀的方法以聚二甲基硅氧烷(PDMS)材料来制作芯片,并建立了一套相对完善的芯片加工方法,在芯片实验室研究领域得到很快的推广和应用。
白念珠菌(Candida albicans)是一种机会性致病真菌,通常共生于健康个体中,对机体不产生侵害,但偶尔会引起健康个体的粘膜(口腔/阴道)的表面感染和极少数 情况下皮肤或指甲的感染。
同时它也可能成为侵入性的,在免疫功能低下的宿主中引 起危及生命的系统性和血液性感染,其死亡率可高达 50%。
它是严重真菌感染的最常见原因,并且也是医院感染的常见原因。侵袭性真菌感染的发病率和致死率逐年上升,已经成为人类健康的严重威胁。
芯片局部放大设计图,如下图所示。

芯片的制备
1.准备
模板制作前需要对硅片进行预处理来清除其上附着的有机污染物,从而有利于光 刻胶的粘附。
将硅片和载玻片置于定制的石英玻璃槽上,在石英缸中加入足量食人鱼 洗液(浓硫酸:双氧水=7:3),将硅片浸没于食人鱼洗液中,热板 185 ℃加热煮沸后 计时 1 h,取下放冷,用超纯水淋洗后在缸中加满超纯水超声五分钟,重复两次后置 于烘箱中 85 ℃ 1 h 烘干冷却至室温,在石英缸表面封上保鲜膜备用。
2.匀胶
按照目标通道高度设置匀胶转速,并根据实际得到的胶厚度对转速和时间进行相 应调整。 初始设置第一转速为 500 rpm,时间 10 s,第二转速为 3000 rpm,时间为 30 s, 所用光刻胶为 MicroChem 公司的 SU-8 3025,先在硅片正中间倒 3 ml 左右的光刻胶, 手动匀开,有助于后续保持胶厚度一致。
手动匀开后,将硅片置于水平载物台上放置 15 分钟使胶自整平,从而减轻边缘效应。 将硅片放在匀胶机吸盘正中心,按下吸片阀,开启真空泵,确认硅片吸附牢固,盖上匀胶机盖子,启动,开始甩胶。待匀胶结束依次关真空泵,关吸片阀,取下硅片。
3.前烘
根据 SU-8 3025 光刻胶的使用说明,对于厚度为 50 μm 的胶,需要前烘 15 min。 打开热板预热至 95 ℃,将匀胶后的硅片置于其上,待前烘完成取下室温放冷,检查 光刻胶表面是否洁净,若由于气泡的存在或附着了空气中的少量纤维等影响后续实验 则弃用,否则继续下一步曝光。
4.曝光
在前烘的同时,打开光刻机预热15 min,曝光前先用紫外辐照计测定实时光强, 并根据光强确定曝光时间。50μm 厚的光刻胶所需曝光剂量为 150-250 mJ/cm2。
一般根据显影结果来调整曝光剂量,防止过曝导致模板结构粗糙,或者曝光剂量不足,光 刻胶对硅片粘附性不够而在显影过程中脱落。
将前烘后的硅片放在光刻机载物台的正中间,微调定位螺丝从而使硅片位于紫外 光照射的中心区域,覆盖掩膜,由于掩膜的菲林材质较软,在其上盖一层石英玻片来 保证掩膜与硅片紧密接触。设置光刻机曝光时间,按下分离曝光键,开始曝光。
对于 负性光刻胶,接受光照部分的光刻胶发生不可逆交联反应,在后续显影过程中可以保 留图形通道。曝光结束后,取下硅片进行后烘。
5.后烘
后烘可以除去光刻机中残余的溶剂并促使光刻胶进一步发生交联反应。对于 50 μm 厚的光刻胶后烘程序为 65 ℃ 1 min,95 ℃ 5 min,后烘完成取下放冷至室温。
6.显影
在玻璃皿中加入适量显影液,设置摇床转速为 60 rpm,转速过快显影液容易洒 出。将硅片没入显影液中,观察显影效果,由于摇床为横向摇动,在显影过程中需要 不断转动玻璃皿,从而避免某个方向的光刻胶过度显影,待通道结构外的光刻胶完全 除去后,用镊子取出硅片,显影液淋洗。
然后,用压缩空气对准没有通道结构的地方 将硅片吹干,注意控制气压,防止吹力过大导致通道脱落。吹干后,显微镜下观察显 影是否完全,尤其是通道最窄的地方要确保显影完全,否则影响后续通道成型。
7.PDMS 配制
一般情况下 PDMS 厚度为 5 mm,需要 PDMS 预聚剂 A 约 25 g,固化剂 B 2.5 g, 在一次性塑料杯中称重。搅拌均匀,保证 A 和 B 成分充分反应,产生大量气泡。
8.PDMS浇筑和固化
将硅片模板置于 90 mm 一次性塑料皿中,用 3 M 无痕胶带固定四个点,防止倒 PDMS 和抽真空过程中硅片浮起导致通道不同位置 PDMS 厚度不均匀。
固定后,检 查模板表面是否有异物,若有及时除去,若无将配好的 PDMS 倒入皿内,置于真空干 燥器中,抽真空 1-2 h,取出观察抽真空效果,并用洗耳球吹破 PDMS 表面的气泡, 直至无气泡为止。
烘箱温度预设为 85 ℃,将载物架调整至水平,放入抽完真空的 PDMS,烘 2 h 后关烘箱自然冷却。
9.剥离打孔
PDMS 固化后,用手术刀沿着辅助线切下,尽量切到硅片保证通道结构部分完全 分离同时避免切到通道,四角连接处分别用手术刀和镊子翘起,小心剥离 PDMS 防 止损坏模板。在通道的进出口位置用打孔器垂直打孔。将芯片切分备用。
10.清洗
将切好的 PDMS 浸泡于异丙醇中,对其表面进行清洁,然后超声清洗 2 min。 取出异丙醇淋洗吹干,置于塑料皿中,65 ℃烘半小时。
11.等离子体处理
取出清洗好的 PDMS 和载玻片,通道结构面朝上置于等离子体机的石英载物台 上,关闭真空舱舱门。抽真空计时 2 min,将三通阀箭头扭到竖直方向。
按下等离子 体机电源按钮,调频旋钮扭到高档位置,观察舱内情况,待真空舱出现灰白色辉光 时,将三通阀箭头扭朝左,此时真空舱内变为粉紫色,打开针型阀通入少量空气, 通入空气避免过量导致辉光现象消失,之后计时 2 min。
12.键合
等离子体处理结束后,关闭调频旋钮和电源及真空泵电源,三通阀箭头扭向 右,缓慢通入空气,防止通气过快掀翻石英载物台上的 PDMS,通完气迅速打开舱 门,于1 min 内取出 PDMS 与载玻片对粘,小心手动按压使PDMS与载玻片充分接 触,对于较宽的通道不可以按压,防止通道塌陷。
待PDMS 与载玻片之间的空气完 全排除后,轻推 PDMS 侧面检查键合是否牢固,若键合牢固则键合完成。
13.疏水处理
本实验所使用的液滴生成微流控芯片包裹的液滴为油包水结构,需要对通道壁 进行疏水处理,防止水相挂壁。由通道出口处用 1 ml 注射器向通道内注入 Aquapel 玻璃镀膜剂进行疏水处理,2 分钟以后用 5 ml 注射器通过空气将 Aquapel 排出。
无尘纸擦拭芯片表面,用无痕胶带清理芯片表面,再用胶带覆盖通道出入口,防止污 染。键合完成的芯片置于塑料皿中室温储存,使用前用铝箔纸包裹,高温高压灭菌 (120 ℃,30 min)。
抗白念珠菌药物筛选
抗真菌药物筛选实验的浓度梯度液滴生成芯片设计图,如下图所示。
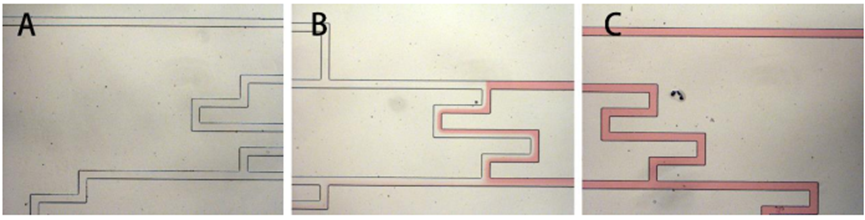
1.培养液配置
沙堡葡萄糖琼脂(Sabouraud dextrose agar,SDA)固体培养基:精密称取蛋白胨 10.0 g、葡萄糖 40.0 g、琼脂 18.0 g,加入三蒸水 900 ml 溶解,pH 值用 NaOH 调整至 7.0,三蒸水定容至 1000 ml,121℃高压灭菌 15 min 后在超净台内倒出适量入培养皿 中,紫外照射待凝固后,倒扣于超净台内吹干上盖的水珠后储存于 4℃备用。
酵母浸出粉胨葡萄糖(Yeast Extract Peptone Dextrose,YPD)培养液:精密称取 酵母浸膏 10.0 g、蛋白胨 20.0 g、葡萄糖 20.0 g,加入三蒸水 900 ml 溶解,三蒸水定 容至 1000 ml,121 ℃高压灭菌 15 min,分装后每瓶约 200 ml 于 4 ℃储存备用。
RPMI 1640 液体培养基:取 RPMI 1640 粉末一包约 10.0 g,精密称取 NaHCO3 2.0 g,MOPS 34.5 g,加入三蒸水 900 ml 溶解,pH 值用 NaOH 调整至 7.0 后,三蒸水定 容至 1000 ml 后经 0.22 µm 微孔滤膜过滤除菌,分装后每瓶约 250 ml 于 4℃储存备 用。
PBS 缓冲溶液:精密称取 NaCl 8.0 g,KCl 0.4 g,Na2HPO4 0.133 g,KH2PO4 0.06 g,NaHCO3 0.35 g,加三蒸水 800 ml,pH 值用 HCl 调节至 7.2,三蒸水定容至 1000 ml 后经 0.22 µm 微孔滤膜过滤除菌,于 4 ℃储存备用。
2.白念珠菌的培养
从-80 ℃冻存的菌株中挑取少许于 YPD 液体培养基中活化,30 ℃,200 rpm/min 振荡培养 24 h 后,吸取 10 μl 于新的 1 ml YPD 液体培养基中,继续在 30 ℃,200 rpm/min 振荡培养 16 h,用 SDA 固体培养基划板,30 ℃培养 48 h,待长出大量单 克隆菌落后,置于 4 ℃储存备用。
实验时挑取 SDA 平板上的单克隆菌落于 1 ml YPD 液体培养基中,30 ℃,200 rpm/min 振荡培养 16 h,使其处于对数生长后期用于后续实验。
3.菌悬液制备
将培养至对数生长后期的菌液转移至离心管中离心去上清,收集细胞,用 PBS 缓 冲液重复 3 次清洗去除残余的培养基后,将细胞用 1640 培养基重悬。
取 10 μl 菌液, 加入 990 μl 1640 培养基中稀释 100 倍,涡旋混匀后用血球计数板计数,取稀释并混 匀后的菌液 10 μl,滴于计数板上的盖玻片内,于显微镜下计数。
血球计数板中间区 域用于计数体积较小的细胞,该区域由 1mm×1mm 的正方形构成,其面积为 1 mm2 包括 25 个大格,每个大格又被均分为 4×4 的小格,计数结果为:细胞数(CFU/ml) =5 个大方格的细胞数目总和/5×25×104×稀释倍数。
通过计数估算出菌液浓度后, 将菌液初浓度调整至 1×108 ~5×108 CFU/ml 的范围后,再稀释到实验所需浓度的菌 液(一般为,0.5×103~2.5×103 CFU/ml),备用。
三、芯片实验
分别配制 100 μl 含药水相溶液和 100 μl 含菌液水相溶液,其中含药水相溶液包 含药液、阿尔玛蓝(刃天青,终浓度 250 μg/ml),含菌液水相溶液包含白念珠菌 (终浓度 0.5×103~2.5×103 CFU/ml)、阿尔玛蓝(刃天青,终浓度 250 μg/ml)。
根 据 CLSI 的 M27-A3,各待测药物的起始浓度分别为:氟康唑 64 μg/ml,两性霉素 B 16 μg/ml,卡泊芬净 8 μg/ml,5-氟胞嘧啶 64 μg/ml,特比萘芬 32 μg/ml。设定无药阳 性对照组(含菌)和空白对照组(无菌)。
油相为 HFE-7500(含 1% EAsurfactant)。采用多浓度梯度液滴生成芯片(图 2- 17),液滴生成后收集到灭菌的 0.2 ml 离心管内 30 ℃条件下孵育 2 h,液滴生成平台见图 3- 1 A,图 3- 1 B 为液滴 生成芯片及液滴生成后收集装置示意图。
图 3- 1 液滴微流控芯片平台与芯片示意图

© 2025. All Rights Reserved. 苏ICP备2022036544号-1















