参考文献:Interfacial engineering for biomolecule immobilisation in microfluidic devices – ScienceDirect
本文概括了用于微流体器件surface modification的不同技术,这些技术被分为气相处理和湿化学处理两大类。
气相处理方法包括化学气相沉积(CVD)、紫外/臭氧处理以及等离子体处理,而湿化学处理方法则包括硅烷化处理和层层自组装(LBL)合成。
1. 化学气相沉积(CVD)
在CVD过程中,气态材料在气相或基底表面发生反应,形成固体表面涂层。
在此过程中,被输送到CVD反应室的气态前驱体在热能的促进下发生反应,形成气相中的活性物种。
随后,前驱体与碳物种被输送到基底表面并通过表面吸附结合。
吸附的前驱体在表面发生反应,包括分解和活性物种的形成。这些物种扩散到表面或相互碰撞,最终克服障碍引发成核。
通过调节生长参数(如压力、温度、气体流量、源材料量及源-基底距离),可控制层数、尺寸、形态和取向。
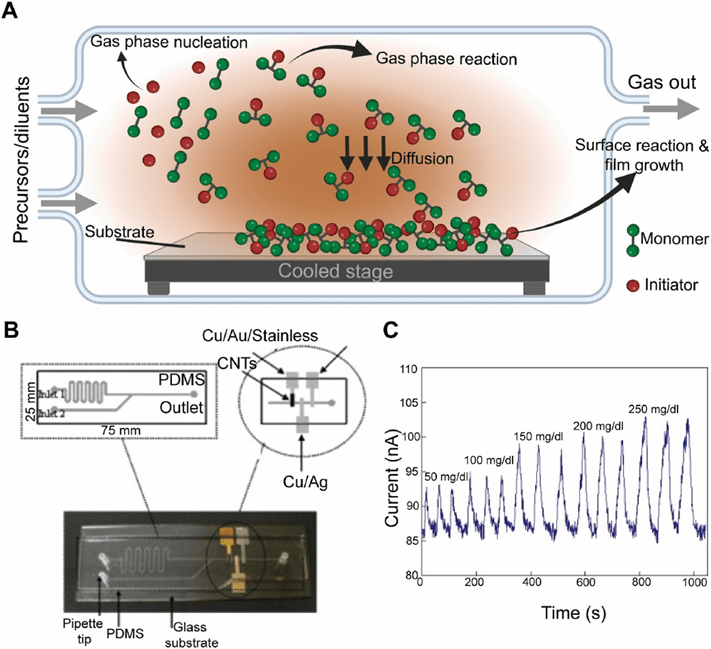
Xu等人开发的引发CVD(iCVD)胺功能化薄膜可在非平面表面形成均匀涂层,应用于PDMS微流体通道后能与硅、玻璃和聚碳酸酯等材料稳定粘合,所得器件具有优异的水分解稳定性(满足细胞培养24小时以上的生物应用需求),且通道内胺基团为生物分子固定化提供了条件。
另一项研究显示,通过CVD在PDMS微通道内制备的聚对二甲苯(含活性酯基团)能快速与生物配体或蛋白质反应,实验证实内皮细胞会选择性粘附于固定生物分子的微通道表面。
2. 紫外线/臭氧处理
紫外线处理可有效改性热塑性塑料表面特性:300-400 nm紫外光通过光氧化和链断裂引发热塑性塑料降解,而160-240 nm紫外光处理PDMS时能分解氧气生成臭氧,显著增强电渗流稳定性并减少分析物吸附,且比氧等离子体处理更深入且不损伤基底。
对于COC、PC等材料,180-190 nm UV/臭氧处理可引入羧基、羟基等活性基团(维持亲水性达14天以上),这些基团不仅能共价固定蛋白质,还能促进细胞粘附,为微流控器件表面功能化提供了温和而持久的改性方案。

Schutte等通过185 nm紫外光照射注射成型COC微流体芯片,诱导表面羧基形成,尽管其密度在45天后下降50%,但蛋白质结合能力不受影响;经胶原蛋白I型修饰后,可实现肝细胞的选择性黏附。
Khetani等则在PDMS微通道内填充多巴胺和去甲肾上腺素单体,通过紫外光引发聚合形成稳定涂层,与未修饰芯片相比,该涂层显著提升了CAD细胞的存活、黏附、增殖及基因表达水平。
3. 等离子体处理
等离子体处理因其能增强表面生物分子附着力和润湿性而广泛应用于生物领域,适用于不同尺寸和几何形状的基底。
该技术通过电离氩、氧或氮等气体,使活化粒子与基底反应,调控表面官能团而不影响材料本体性能。
在微流体领域,氧等离子体处理常用于PDMS改性,通过氧化生成硅羟基(Si–OH)增强亲水性,促进毛细流动、生物粘附及PDMS与盖玻片的不可逆键合。
其可调参数和可重复性使其成为微流体器件制备的关键技术,推动了生物学研究的发展。
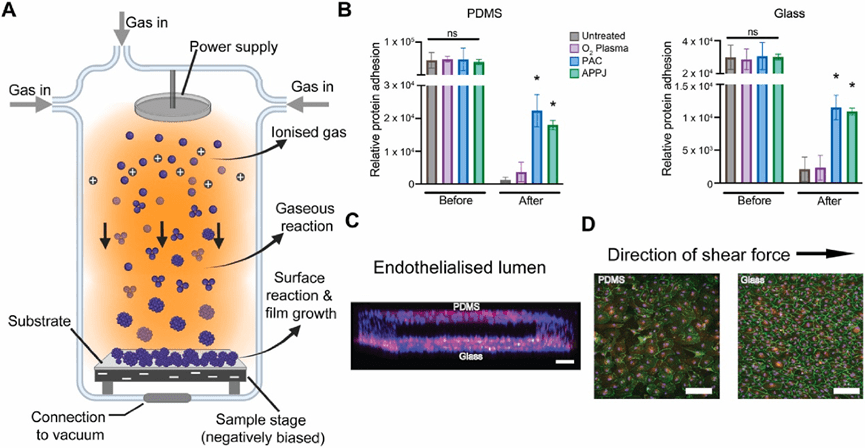
Tan等人发现,PDMS经单次或多次(100-500秒)等离子体处理后,水接触角降至17°–46°(亲水性显著提升),且改性效果可维持6小时,满足商业化器件制造需求。
进一步研究表明,江等人通过微尺度氧等离子体处理证实PDMS表面化学组成(如羟基含量)和润湿性发生显著变化,而形貌和粗糙度几乎不受影响。
4. 硅烷、碳二亚胺和席夫碱化学
湿化学法中的硅烷化是表面氨基化的常用策略,通过APTMS或APTES等硅烷偶联剂在聚合物、玻璃等基底上引入氨基,实现生物分子的共价固定。
该过程通常需结合等离子体处理或酸蚀刻等预处理以生成表面羟基,再通过液相沉积或化学气相沉积接枝硅烷。
硅烷的末端基团(如胺基/羧基)可特异性偶联蛋白质的羧基/胺基,形成带正电、生物相容性良好的功能化表面(APTES/APTMS处理后接触角分别为66°/74°),显著促进细胞黏附与生物分子固定。
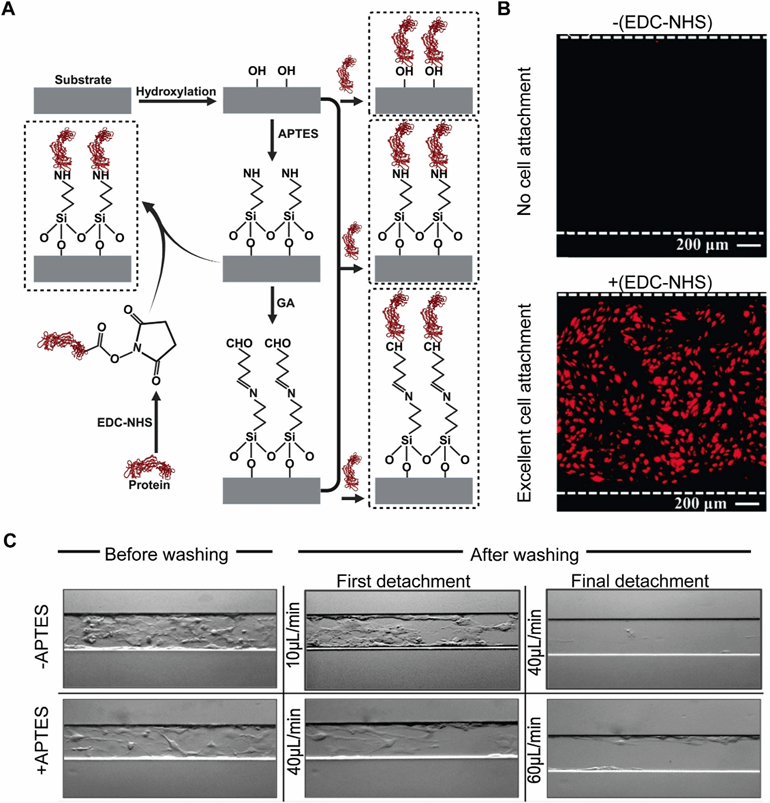
Siddique等采用APTES对PDMS微通道进行功能化处理,作为PDMS与ECM蛋白的连接桥接剂,显著增强了蛋白质层的稳定性和细胞增殖能力。
经APTES修饰的通道表现出优异的流体剪切阻力——细胞初始脱落流速提升至40 μL/min(未处理组10 μL/min),完全脱落流速达60 μL/min(未处理组40 μL/min)。
这种增强的力学稳定性使该装置适用于生物力学研究,例如模拟冠状动脉剪切应力对内皮细胞的影响。
5. 层层自组装
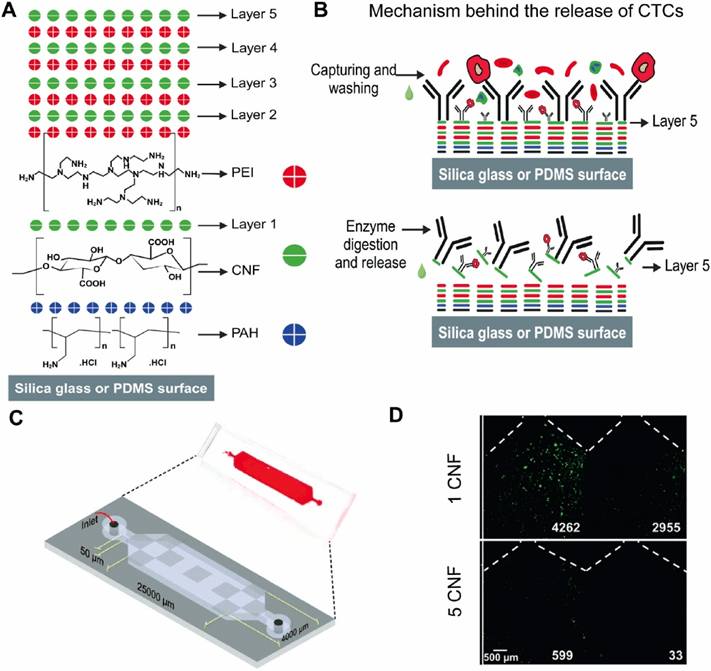
层层自组装(LBL)沉积是通过将带电基底浸入含有相反电荷物种的溶液中,并经过中间冲洗和干燥步骤,形成多层结构的过程。
每次浸渍步骤包括从浸渍溶液中沉积一层带电物质,并反转表面电荷,从而使下一层相反电荷的物质沉积。
通过调整组装参数,如浸渍溶液的离子强度、组成、温度和pH值,可以控制涂层特性,如层组成、地形、厚度以及相邻层之间的混合程度。
Lin等开发了一种双层organ chip,通过集成细胞培养微通道(40×1×0.05 mm)和生物传感微沟槽(500×100×200 μm),实现了细胞形态监测与葡萄糖/氧气浓度的同步检测,其基质辅助LBL封装技术为drug screening提供了新平台。
Li等则采用LBL技术在微流控通道构建了14 nm厚的五层CNF可降解涂层,通过酶解实现CTCs的高效捕获与无损释放,在保持细胞活性和增殖能力的同时展现了优异的循环肿瘤细胞分选性能。
6. 其他表面处理技术
电纺丝是一种利用电场从聚合物溶液中制备纳米纤维的技术。
在此过程中,聚合物溶液被注入注射器并带正电荷,随后以最佳流速泵出并沉积在带相反电荷的收集板上。
电纺丝技术被用于制备聚乳酸-共-乙醇酸(PLGA)基纳米纤维界面,以在微流体芯片中高效捕获循环肿瘤细胞(CTCs)。
纤维被纺制在玻璃盖片上,并通过PMMA或PDMS与具有腔体的基底结合。
纤维表面通过共价键固定上上皮细胞粘附分子(EpCAM)抗体或透明质酸(HA),以提高肿瘤细胞的捕获效率。
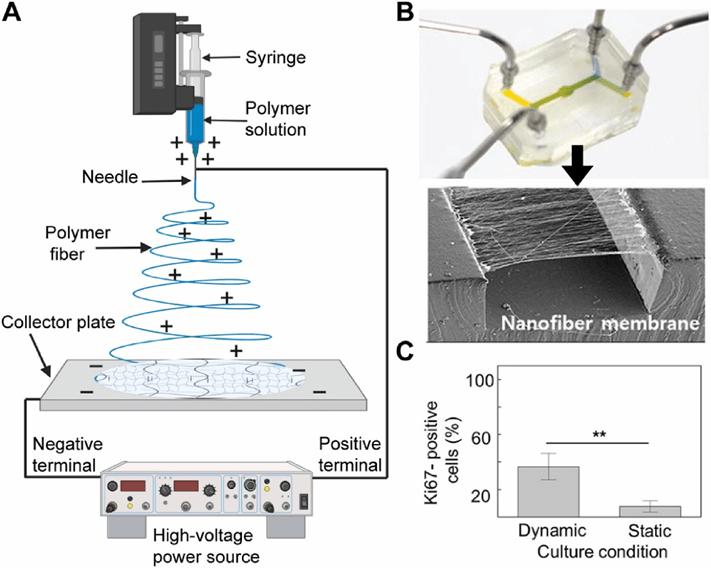
Rhyou等成功在PDMS微流控芯片中集成电纺聚己内酯膜,实现7天流式培养下人类角质形成细胞95%的高存活率,该电纺界面经化学活化后可共价固定生物分子。
Kim团队则创新性地利用图案化PDMS微通道结合溶胶-凝胶技术,在亲水化处理的玻璃基底上构建了具有活性IgG的微图案,通过免疫结合实验证实了蛋白质功能的完整保留,为蛋白质芯片开发提供了新策略。
© 2025. All Rights Reserved. 苏ICP备2022036544号-1















