参考文献:点击此处
由于动物模型或二维cell culture模型往往无法准确预测药物代谢和代谢产物对人体的毒性,要最大限度地降低后期失败的风险,就必须提高临床前研究的预测有效性。
因此开发出了organ chip系统,通过连接单个器官模块或在单个芯片上组合多个器官模型来建立多器官芯片,模拟器官间的交流,从而再现人体的生理过程。
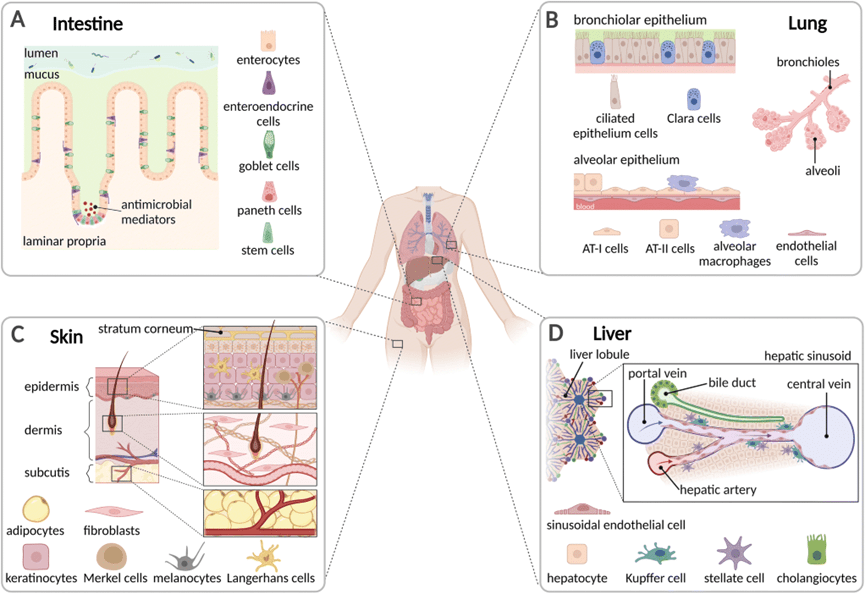
1. 器官模型在药物测试中的进展
1) 脱靶代谢和毒性研究
药物的代谢并不依赖于单一器官,而是依赖于多个器官的相互作用。
肾脏的肾近端小管负责通过肾小管分泌或重吸收清除外源性物质,这可能导致药物诱导的肾毒性。
另一个常见的副作用是候选药物的心脏毒性,往往导致临床试验失败。
因此,研究人员开发了一种集成悬臂和 MEA 的芯片,通过测量存活率、传导速度、收缩力、QT 间期和搏动频率,研究肝脏代谢药物对 iPSC 衍生心肌细胞的心脏毒性。
该芯片还可扩展到影响合成皮肤替代物,以研究局部用药后的药物毒性,这对于对消化道有副作用的药物尤为重要(图A)。
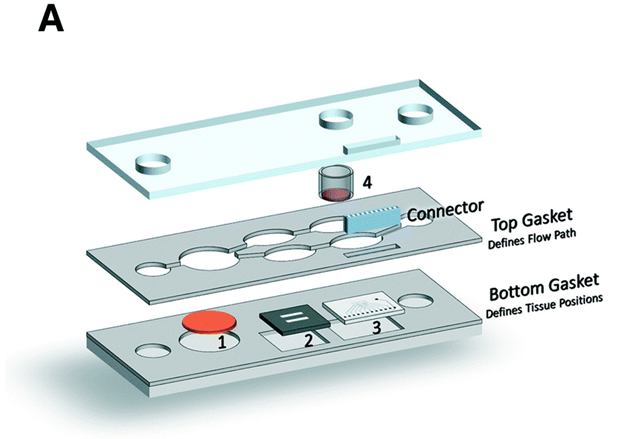
2) 靶上和靶下药物毒性研究
为了评估药物对非靶组织可能产生的副作用或次级代谢物对靶组织和非靶组织的毒性,可以进一步整合器官模型。
有研究者连接了肝脏、心脏和肺脏模型,分别在不同的芯片上培养,并使用蠕动泵进行循环液体输送(图B)。
在灌注的第三天,注射了博莱霉素(针对肺组织),虽然这种药物并不具有心脏毒性,但还是观察到心脏类器官的形态发生了变化。
在后来的研究中,该平台扩展到包括六种不同的组织模型(肝脏、心脏、肺、结肠、脑、血管),以研究在肝脏代谢为活性形式的抗癌药物的毒性。
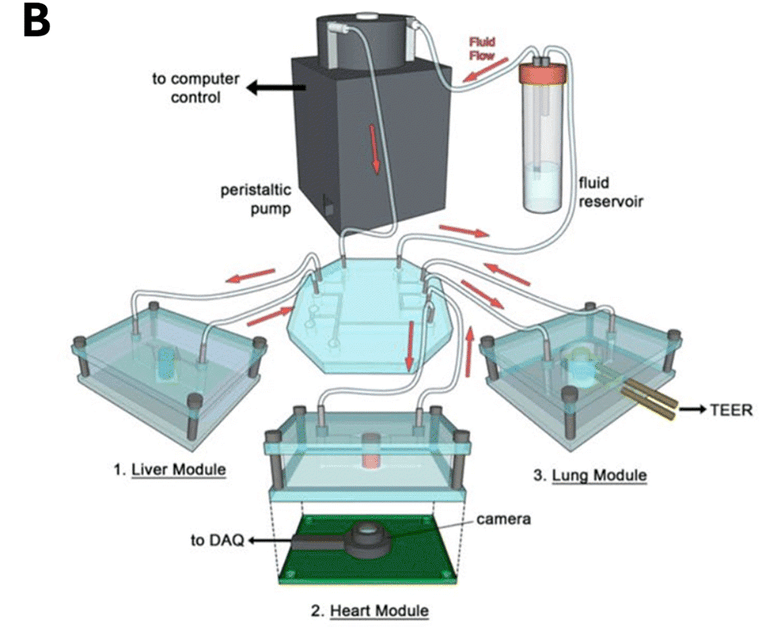
另有相关研究指出了器官模型与血管流动的联系,展示了一种多器官芯片(肝脏、心脏、骨骼、皮肤、血管),其中包含了事先培养和分化(来自 hiPSC)的器官模型。
组装完成后,各组织由内皮屏障隔开,但与循环血管流相连,并用肝脏代谢药物多柔比星测试药物筛选能力(图C)。
研究表明,成熟的表型可在芯片中维持四周,临床 PK/PD 曲线也得以重现。
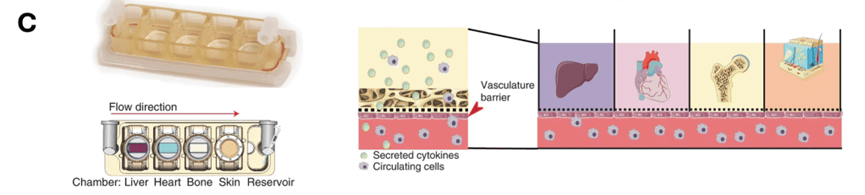
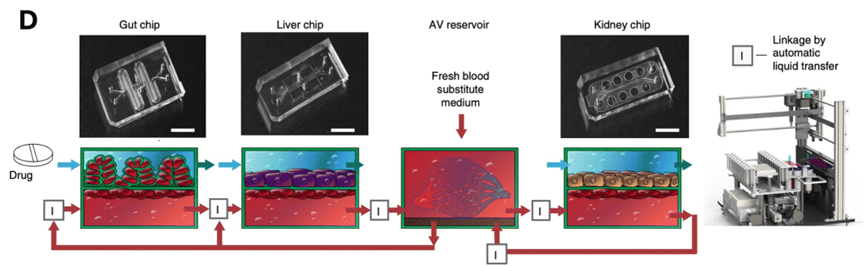
通过在肠道、肝脏和肾脏模型或骨髓、肝脏和肾脏模型的内皮衬里血管通道之间转移液体来模拟药物在血液循环中的转运,研究了器官芯片模型的 PK 反应(图D)。
因此,可以预测尼古丁和顺铂的 PK 参数,而且还可以复制在人体中观察到的 PD 反应,这证明了器官芯片模型从体外到体内转化的潜力。
2. 推进多器官芯片的应用
1) 复杂性和易用性
复杂性在于设备操作处理程序复杂,不同器官模型需要特定培养基。
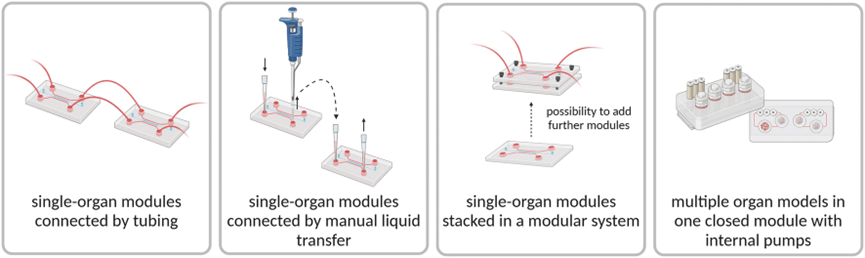
为了应对这些挑战,一种方法是在初始开发阶段将相关器官模型进行空间分隔,然后在实验阶段进行组合。
这种模块化策略正在成为一种有效的解决方案,可用于管理日益复杂的多器官系统,同时还能在组装多器官系统前执行质量控制步骤,并简化对单个区室的终点分析。
模块化微流控系统面临的主要挑战是如何使用各种管道、鲁尔接头、O 型环接头以及粘合剂确保组织间无菌、安全和可靠的连接。
为了实现模块化生物芯片系统的标准化,研究人员开发了稳定的机械连接,类似于乐高式连接器、磁辅助、形状互补和螺纹接头。
使用的另一个例子是基于螺钉的方法,将膜模型堆叠在一个模块化平台上,用于共同培养胃肠道和肝脏。
还有一种类似俄罗斯方块的模块化方法,通过磁铁连接不同的模块。
通过研究槲皮素对肝脏内皮细胞模型的影响,以及环磷酰胺对由肝脏、内皮细胞和肿瘤组成的三组织模型的化疗特性,证明了所引入系统的可行性。
2) 高通量和自动化
一般来说,要利用多器官模型进行High-throughput drug screening,介质交换必须是可自动化的。
例如研究人员开发的一种仪器,可通过机器人技术和定制软件自动处理液体,并通过集成显微镜成像。
这样,八个不同的流体耦合器官芯片模型就能在三周内保持活力。
通过使用带有血管屏障的双通道器官模型,可以为器官模型提供所需的culture medium,同时通过在内皮衬里的血管通道之间传输培养基来维持质量运输,而不需要管道连接。
另一种方法是根据微孔板的尺寸设计平台,从而可以使用移液机器人,并允许使用标准实验室设备(如平板阅读器)进行读数。
研究人员开发了一种用于高通量筛选的器官芯片平台,该平台以标准平板为基础,可进行 96 次培养。
该平台可用于共培养研究,并集成了用于测量屏障功能的电子传感器和用于测定溶解氧的光学传感器。
Site Search
Recommendations
© 2025. All Rights Reserved. 苏ICP备2022036544号-1















