单细胞分析为重大疾病的早期诊断与治疗、药物筛选及细胞间相互作用研究提供了可靠的科学依据。微流控芯片具有与细胞尺寸相当的微通道结构,并可根据需求调整通道的尺寸和形状,已经成为单细胞分析的强大工具。基于微流控芯片的单细胞分析具备样品消耗少、检测速度快、通量高的特点,非常适合用于样本量较少的检测。
单细胞捕获是单细胞分析的关键步骤,只有成功捕获单细胞后,才能进行后续分析。微流控芯片因其高度可控性和强大的单细胞处理能力,已成为单细胞捕获的主要平台。
基于微流控芯片的单细胞捕获方法主要分为两类:
1. 基于外力的捕获方法:利用磁力、光力、声波和电场等外力实现单细胞捕获。
2. 基于流体动力的捕获方法:无需任何外力和标记,仅依靠流体流动和细胞形态的固有差异在微通道中捕获单细胞。该方法对细胞活性几乎无影响,是一种低成本、简单且高通量的单细胞捕获方法。
1. 基于流体动力的微流控芯片单细胞捕获方法及原理
基于流体动力的微流控芯片单细胞捕获,通过在流体通道中设计障碍物或凹槽等微结构,利用结构与流体、细胞与流体以及细胞与结构之间的相互作用,通过精确控制通道内的流体及单细胞的运动,实现单细胞捕获。
常用的流体动力单细胞捕获方法包括:确定性侧向位移技术(DLD)、惯性微流控技术和过滤技术。
DLD技术利用流体的层流特性及细胞大小差异,当细胞与微柱阵列发生碰撞时,基于相互作用,不同尺寸的细胞沿不同方向流动。尺寸大于流体动力学临界尺寸的细胞会发生侧向偏移,随着流体流出微柱阵列;
而尺寸小于临界尺寸的细胞不会偏移,被拦截在微柱之间的空隙中,从而实现单细胞捕获。DLD技术可以分离不同尺寸的细胞,并在微流控芯片出口处设计单细胞捕获结构,实现对不同尺寸的单细胞捕获。
惯性微流控技术基于不同尺寸细胞所受的惯性升力差异和Dean涡流原理进行单细胞捕获。细胞的尺寸决定了其受惯性升力的大小,较大的细胞向通道内壁方向移动,较小的细胞向通道外壁方向移动。
通过设计多个微流控芯片出口,可以实现不同种类细胞的分离,或在不同出口处设计单细胞捕获结构,实现多种单细胞的捕获。惯性分选的微通道通常为直通道、螺旋通道或其组合。
过滤技术根据细胞大小和变形能力的差异,通过控制微筛或微孔尺寸实现单细胞捕获。当细胞通过微筛或微孔时,尺寸较大或变形能力较差的细胞会被困住。通过调节微筛或微孔的尺寸,可以从混合细胞样品中选择性地捕获某种单细胞。
2. 基于流体动力的微流控芯片单细胞捕获结构
根据微流控芯片的结构设计不同,单细胞捕获主要分为微井结构、微柱结构和旁路通道结构。
微井结构:设计与单细胞尺寸相匹配的微井,当细胞悬浮液流过时,单细胞在重力作用下沉降到每个独立的微井中。由于沉降细胞所受流体冲击力较小,不易被冲走。
微柱结构:在通道内设计各种形状和尺寸的挡板或障碍物,通过拦截单细胞实现捕获。每个捕获点旨在尽量容纳单个细胞,形成单细胞捕获阵列。
旁路通道结构:通过通道中不同位置的流体阻力差异来捕获单细胞。细胞悬浮液沿通道流动时,单细胞优先进入流体阻力较小的区域。被捕获的单细胞如同“塞子”,增加该位点的流体阻力,使后续细胞绕过已占据的捕获点,继续流向下一个捕获点。
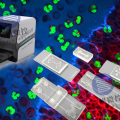
1) 基于微井阵列的单细胞捕获结构
基于微井阵列的单细胞捕获结构,通过重力沉降法实现单细胞捕获。这种方法依靠单细胞与微井尺寸的匹配,使得细胞能够在不同大小和形状的微井中被捕获。
作为最早的单细胞捕获设计之一,这种结构基于过滤原理:首先将细胞悬浮液注入微流控芯片中,静置一段时间,利用细胞的重力作用使其沉降到微井内,然后冲走多余的细胞,完成单细胞捕获。
基于微井阵列的捕获方法可以从大量细胞样本中分离出单细胞和细胞团簇,主要分为封闭式和开放式两种结构。
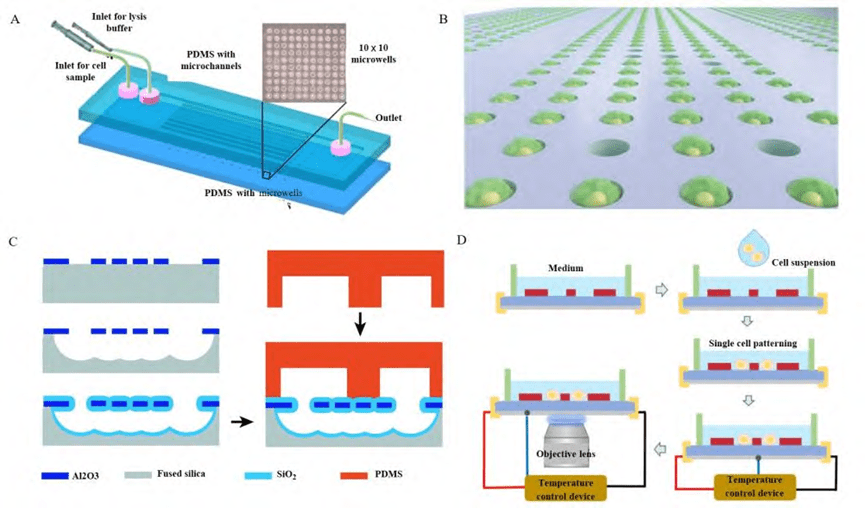
2) 基于微柱阵列的单细胞捕获结构
微柱阵列结构是单细胞捕获的常用设计之一,基于单细胞的尺寸优化微挡板或障碍物,使每个微柱结构仅捕获一个细胞。
通过DLD(确定性侧移)原理,细胞在流体通道中流动时,微柱阵列通过流体流线引导,捕获单细胞。当单细胞被捕获后,该位置的流体阻力增加,降低了捕获其他细胞的概率。无论是单细胞、细胞团簇,还是从全血样本到裂解样本,各种形状和尺寸的微柱结构均能有效捕获。
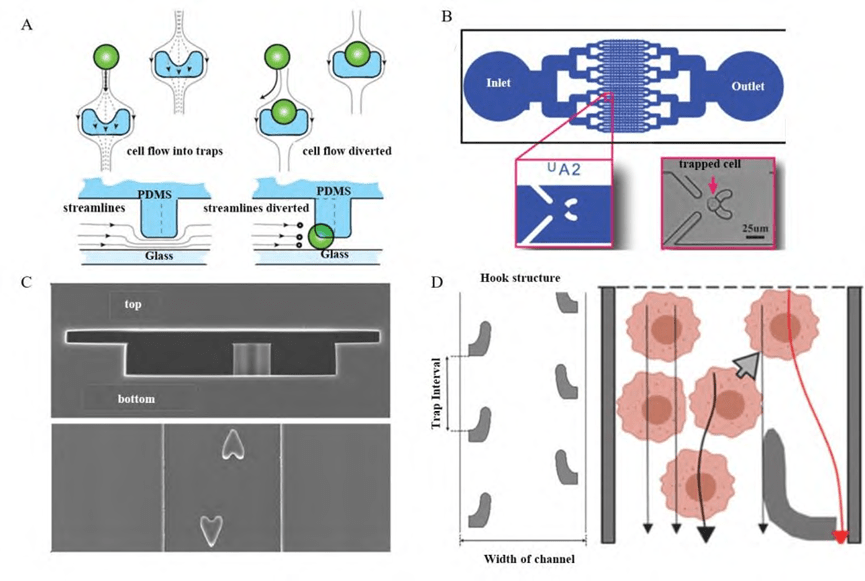
3) 基于旁路通道的单细胞捕获结构
基于微柱阵列的单细胞捕获结构通常与主通道流动方向垂直,而基于旁路通道的单细胞捕获结构则与主通道流动方向平行,通常由一个捕获点和侧通道组成。
该结构利用DLD(确定性侧移)和惯性微流控原理,在微流控芯片中设计出流阻较大的主通道和流阻较小的侧通道。当细胞在主通道中流动时,由于主通道与侧通道之间的压力差,细胞会被引导进入流阻较小的侧通道。通过在主通道和侧通道连接处的特殊捕获结构,实现单细胞捕获。
捕获的单细胞在捕获点如同“塞子”,增加了该位置的流体阻力,使得后续细胞绕过已占据的捕获点,继续向下一个捕获点流动。该设计减少了通道堵塞和多细胞聚集,降低了细胞损伤风险。基于旁路通道的单细胞捕获结构提供了一种按顺序捕获单细胞和细胞团簇的方法,同时也能实现细胞分裂时子细胞的分离。
© 2025. All Rights Reserved. 苏ICP备2022036544号-1