三维细胞培养使得细胞之间、细胞与胞外基质之间的相互作用成为可能。类组织和类器官是多能干细胞分化后的各种细胞通过自组装形成的三维微型组织,其结构和功能类似于人体器官。
微流控技术的引入,不仅能够提供力学微环境,还能模拟人体器官在空间和时间维度上变化的生化和结构微环境。同时,生物传感等实时监测技术的应用,可以实现对三维模型的长期无损重复检测,包括生物物理、生物化学信号,以及pH值和氧水平的测量。
在药物发现和毒性筛选方面,虽然目前的体外三维模型由于发展水平的限制,仍然无法完全替代动物实验,但由于其细胞来源于人类,有些情况下体外三维模型的准确性已超越了动物实验。
1. 3D-CMCs模型的研究
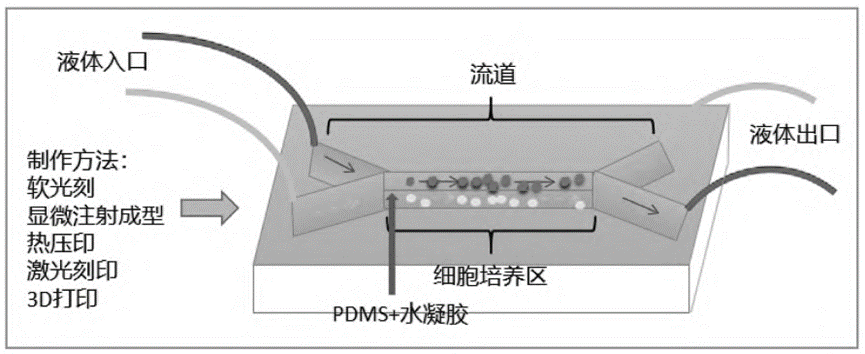
3D-CMCs(3D细胞培养芯片)是一种融合了人体生理学、组织工程、干细胞生物学、微工程、材料学、力学、药学及机械等多学科交叉的技术。3D-CMCs的核心是在微流控芯片上构建三维细胞模型。目前微流控芯片的共性主要体现在材料选择、区域划分和制作技术上。
理想的生物材料应具有以下特性:最小的细胞毒性和生物分子、药物吸收,透明以方便芯片成像,具有良好的气体通透性以确保细胞的氧气供应,同时为3D细胞提供结构支持,并能促进健康或病变组织的表型和功能。
其中,聚二甲基硅氧烷(PDMS)具有低细胞毒性、优异的光学透明性和透气性,因此被广泛用于3D-CMCs。然而,PDMS会从溶液中吸收疏水性小分子或药物。为了克服这一问题,通常将水凝胶这种亲水性生物材料涂敷在PDMS表面,以减少药物吸收。因此,PDMS和水凝胶的组合在微流控芯片构建中十分常见。
微流控芯片的功能区划分基本一致,包括进出口、流道和细胞培养区。常见的微流控芯片制作技术有五种:软光刻、显微注射成型、热压印、激光刻印和3D打印。
在构建3D-CMCs时,3D生物打印技术不仅可以用于打印作为反应容器的微流控芯片,还可以打印仿生组织作为反应受体。其便捷性和可定制性使得3D生物打印成为一项极具前景的技术。通过打印水凝胶,可以定制随时间变化的生化微环境和氧气浓度等因素。
多种细胞类型可用于3D-CMCs模型的构建,如代表性细胞系、多能干细胞、肿瘤细胞系和原代细胞等。在3D-CMCs系统中,血管网络具有重要意义,它能够提供充足的氧气和营养供应,并对微环境进行有效控制,从而实现组织的长期培养和功能化。
目前,3D-CMCs的应用非常多样化,包括构建肝、心、血管、肾、血脑屏障、脾、肺、肠、神经等单一器官模型,以及血管与各种组织器官的组合模型、多器官组合模型等。3D-CMCs模型可广泛应用于药物发现和筛选、器官生长发育、体外病变建模、再生医学及药物毒性研究等领域。
2. 3D-CMCs模型在药物毒性检测中的应用
1) 3D-CMCs模型在肝毒性检测中的应用
利用3D生物打印技术快速高通量生产肝芯片或肝组织,可以显著降低生产成本和操作难度。基于水凝胶的肝芯片系统已经被开发,用于生成仿生肝组织。
有研究者使用琼脂糖和甲基丙烯酰基明胶(GelMA)的牺牲生物打印技术建立微通道网络,将HepG2/C3A细胞封装在GelMA中,并在微通道中植入人脐静脉内皮细胞(HUVECs),从而构建含血管的肝脏模型来评估肝毒性。
近年来,灌注培养技术的创新进一步简化了芯片制作,使其更适合用于药物毒性测试。例如,有些方法不再使用传统的泵,而是通过相位指向或二氧化碳压力驱动实现固定流向的灌注芯片。此外,将类器官培养与微流控芯片结合,可以更精准地控制类器官的生长微环境。
肝损伤的发生和发展是一个动态过程,不能仅依赖终点测量来描述。将芯片与生物传感器结合,可以实现对多种参数的实时监测,从而更全面地反映肝脏健康状况及其对外界刺激的响应。
2) 3D-CMCs模型在心脏毒性检测中的应用
目前,心脏毒性筛查模型主要依赖于二维细胞培养、动物模型和膜片钳技术。然而,正如前言所述,二维细胞模型和动物模型各有其局限性,而膜片钳技术通常需要侵入性操作。因此,亟须开发三维体外模型来更有效地检测药物的心脏毒性。
有研究基于人诱导多能干细胞衍生的心肌细胞(hiPSC-CMs)和多阵列技术,构建了微电极阵列芯片。这种方法能够生成类似于天然心肌的分层心脏组织,并同时测量电生理数据。通过测量心毒性前药(特非那定)和非心毒性代谢物(非索非那定)的反应,该3D细胞培养芯片(3D-CMCs)模型被证明能够有效用于药物心脏毒性筛查。
3) 3D-CMCs模型在肾毒性检测中的应用
研究者开发了一种模拟肾脏器官的3D-CMCs装置,该装置由两个部分组成:微流控药物浓度梯度发生器和肾细胞培养流温控制平台。通过检测肾近端小管上皮细胞和肾小管周围毛细血管内皮细胞,该装置能够有效评估药物诱导的肾毒性。
与传统的二维细胞培养相比,这种三维模型在细胞生长和药物肾毒性评估方面表现出更高的准确性和性能。此外,研究发现,在该3D-CMCs装置中,西咪替丁的干预显著降低了顺铂诱导的肾毒性,这表明该装置在研究药物相互作用和毒性评估方面具有潜力。
4) 3D-CMCs模型在多器官联合毒性检测中的应用
单器官模型的目标是重建特定器官的关键功能单元,而非整个器官,因此往往无法复制不同组织和器官之间的正常或异常相互作用。相比之下,多器官联合芯片的优势在于能将药物代谢和毒性过程整合到一个设备中,方便对药物代谢产物的毒性进行全面评价。
相关研究报道了一种集成多种3D-CMCs的系统,可以并行评估药物对多种组织的药效和毒性。首先,该系统集成了肝脏、心脏和肺部结构,构建出一个多器官芯片,并能够在高存活率的条件下维持21天。通过已知前药卡培他滨在肝脏中的代谢转化为5-氟尿嘧啶,观察到肺和心脏对代谢产物的毒性反应,从而验证了该系统的有效性。
之后,该集成系统进一步扩展以容纳肝、心、肺、内皮、脑和睾丸类组织。培养14天后,通过检测前药异环磷酰胺在肝脏代谢过程中产生的氯乙醛诱导的下游神经毒性,证明了多种组织之间的相互作用。该系统展示了在多器官环境下评估药物效应和毒性的新途径,具有重要的应用潜力。
© 2025. All Rights Reserved. 苏ICP备2022036544号-1







.png&w=120&h=120&zc=1&q=100)





