微流控技术的快速发展,为开发低成本和用户友好的呼吸道病毒监测平台提供了新的策略。
微流控芯片在微小尺度上实现流体的操控,构建出芯片实验室模型,从而将多种化学和生物学的过程集成到微全分析系统中。
与其他分析技术相比较,微流控芯片的最大优势在于实现了操作过程的自动化、检测目标的高通量和试剂的低消耗,排除人为干扰,防止污染,能自动高效的进行重复实验,还具有易于和其他技术设备集成以及兼容性好的特点。
由于微流控芯片具有试剂用量少、反应过程短、灵敏度高、成本低等优点,在化学、生物、物理、医学 等自然科学领域有着广阔的应用前景。
一、实验原理与方法
基于微流控技术的可视化呼吸道病毒免疫检测原理如图1.1所示。
抗原经加样口注入芯片,首先与包被溶解区的胶体金标记抗体反应,在混合区进一步充分混合形成抗原抗体复合物,接着流经检测区,此处的捕获抗体与抗原进行特异性识别,形成抗体-抗原-抗体复合结构,并在检测区聚集。
胶体金为颜色型标记材料,聚集后产生明显的显色反应,通过微流控芯片检测区检测线颜色的有无进行样本中检测目标物的判定。
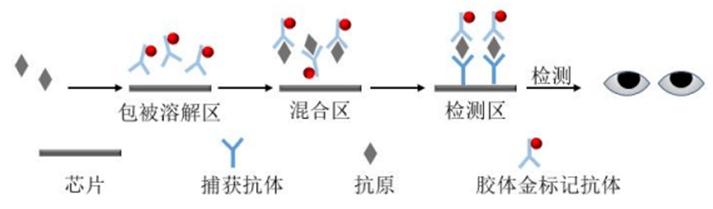
图1.1 基于微流控技术的可视化呼吸道病毒免疫检测原理图
二、胶体金的制备
胶体金的制备采用柠檬酸三钠还原法[128]。具体制备过程如下:在洁净的玻璃器皿中,将250 mL 的去离子水于可加热磁力搅拌器上加热至沸腾,加入2.25 mL 2%的柠檬酸三钠溶液,当溶液再次沸腾后,迅速加入1%的氯金酸溶液2.5 mL,溶液颜色变为酒红色,继续加热煮沸5 min,冷却至室温后用去离子水补足至原 体积,制备好的胶体金溶液室温避光保存
三、胶体金与抗体偶联
根据实验得出的胶体金标记抗体最佳条件,分别对本研究中呼吸道病毒检测 项目的抗体进行标记。经标记及纯化后,为了评估标记效果,用紫外可见光谱检 测、透射电子显微镜对胶体金标记抗体进行表征。
二、芯片的设计与制造
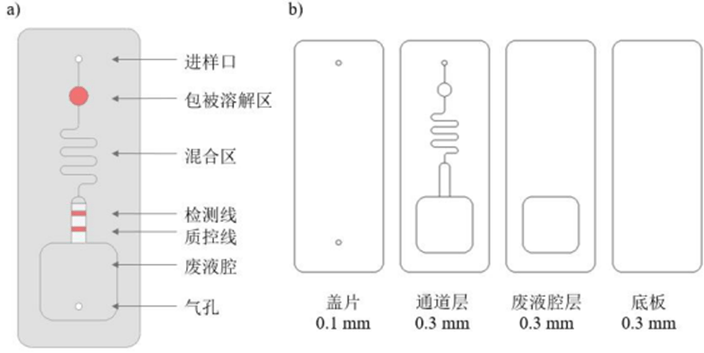
采用 AutoCAD 软件进行芯片设计,微流控芯片由底板、通道层、废液腔层和盖片组成。
如图2.1所示,通道层由进样区、包被溶解区、混合区、检测区构成,盖片为一矩形光板,其上开有两个孔,即一个进样口和一个气孔。底板、通道层、废液腔层和盖片键合形成了密闭微通道,构成芯片的功能区域。
微流控芯片的制作选用聚甲基丙烯酸甲酯(PMMA)为基材。根据 CAD 芯片设计图(如图2.1所示)用激光雕刻机加工而成,芯片共4层,长69.98 mm,宽26.96mm,其中通道层、废液腔层、底板厚度为0.3 mm,盖片厚度为0.1mm。 芯片组装时,将通道层上下底面贴双面胶,废液腔层下底面贴双面胶。
首先将芯片的底板与废液腔层进行贴合,用真空热压机进行热压键合,并对其上表面进行亲水处理。接着将通道层贴至处理好的芯片的上表面,将玻纤切割后嵌入包被溶解区,以其作为载体,滴加胶体金标记抗体;
在检测区嵌入经激光切割好的硝酸纤维素膜(NC 膜),膜上包被有两条捕获抗体线,质控线为 GAM-IgG(C 线),检测线为对应呼吸道病毒的包被抗体(T 线)。
胶体金标记抗体进行干化处理后,再将盖片贴至上层,真空热压键合,制得完整的测试芯片。芯片键合采用贴胶真空热压法进行,方法简便且易于操作,并且加工完后芯片结构稳定。
三、呼吸道病毒微流控可视化免疫检测
采用制作的微流控芯片,分别对甲型流感 H1N1 灭活病毒、乙型流感灭活病毒、呼吸道合胞病毒标准抗原、新型冠状病毒标准抗原进行检测。抗原检测时,将配置好的不同浓度梯度的样本用注射泵通过进样口注入芯片,流速为8 μL/min,反应10 min,观察结果。
© 2025. All Rights Reserved. 苏ICP备2022036544号-1












