构建一种灌胶简便的微流控芯片,用于细胞的三维培养,并可实现多参数调控细胞微环境,用于研究细胞不同的应激反应。同时,还考察该芯片形成稳定的浓度梯度和压力梯度的效果。
- SU8模具加工
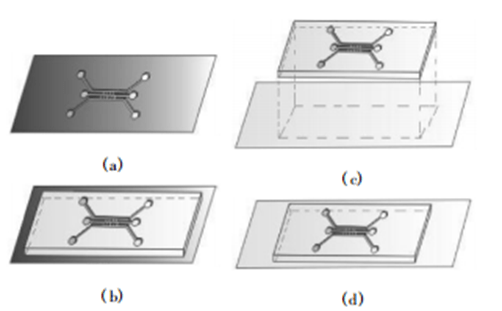
设计了一个由 3 通道 组成的微流控芯片构型,整个微通道的高度为 220 μm。
中间通道用于细胞三维支架的构建,宽为 400 μm,2 个旁通道用于细胞培养液的更新、生化因子的浓度梯度以及压力梯度的 生 成,宽 均 为 500 μm,旁通道与中间通道之间分别由 4 个斜型微 横桥连接,微横桥直径为 250 μm,作用是实现细胞与培养基的物质交换,以及施加对细胞的物理化学 刺激。
同时由于微横桥的尺寸较小,通过毛细力的作用避免了水凝胶渗溢到旁通道中造成堵塞。
- PDMS芯片加工
将 PDMS 预聚体与固化剂按照重量比 10 ∶ 1均匀混合,真空抽气去除气泡后,倒于 SU-8 硅 模板上,80 ℃ 烘箱放置 20min,待 PDMS 固化后,从硅模板上剥离,将带有微通道结构的部分切割成 20 mm × 45 mm 的矩形。
将切割下来 的 PDMS 片和载玻片同时放入等离子清洗器中,其中PDMS片带通道图样的面朝上,在25 W 微波功率 和 26 Pa 氧压下,处理 20 s 后,立即将PDMS片和载玻片取出并将待键合面贴合在一起,轻度挤压,去除贴合面间的气泡,使两键合面紧密贴合,并分别在通道各出入口处打孔,制成微流控芯片( 见下图 ) ,灭菌后备用。
- 水凝胶灌入
将Ⅰ型胶原 原液与 10 × DMEM 培养液,PBS 缓冲液,NaOH 溶液 混合,制成约 3 g /L 的胶原预聚溶液。
将预聚液充分混合好后立即在室温下从中间通道的入口处轻轻注入,使胶原填满中间的通道以及两边的 8 个微横桥( 其中胶原加入蓝色染料以便于观察) ,在37 ℃下聚合 30 min,使其完全聚合后,放入 4 ℃ 的冰箱中备用。
- 芯片内浓度梯度和压力梯度的表征
微流控芯片内浓度梯度和压力梯度的表征 将微通道在 PBS 溶液中平衡30 min。
将新配制 的 0.1 mmol·L-1 的荧光素的 PBS 溶液用微注射泵 以 2 μL·min-1 的流速从其中 1 条旁通道入口注 入,同时另一旁通道以 2 μL·min - 1 的流速注入 PBS 液。以注入荧光素的那一刻计时,利用荧光显微镜每 隔 5 min 拍照一次,共观察9 h。
最后用 Matlab 软件 对中间通道的浓度梯度分布取不同时间点进行分析。 本研究实现压力梯度的原理为通过调节 4 个出 口的储液池液面高度差,在中间通道的三维支架内 形成压力梯度。
为了使体积更加可观,实验中分别 采用红、蓝染料加入 PBS 中 ,平衡 2.5 h 后,形成较稳定的压力差。将两边通道液面的高度差控制在 10 mm,根据压强公式 p = ρgh 可求出中间通道的压力差为 100 Pa。
在实验中,为了避免水分蒸发,在 4 个储液池液面分别接入液态石蜡进行封 闭。将芯片置于高湿度的孵箱内,每隔2 h测量1次液面高度,测量 72 h。

- 三维培养和骨架染色
细胞接种于DMEM培养基中,含 10% 胎牛血清,于37 ℃、5% CO2 及饱和湿度的培养箱中孵育,2~3d 换液 1次。
贴壁生长的细胞长满 90% 时,经 0.25% 胰蛋白酶消化,然后将对数生长期细胞用于实验。 将Ⅰ型胶原原液与 10 × DMEM 培养液,PBS 缓 冲液混合,制成约 3 g /L 的胶原预聚溶液。
将细胞 从培养瓶中消化下来,用培养基制成细胞悬液,将预 聚液与细胞悬液混合均匀,细 胞密度控制 在 106 /mL,立即将细胞和Ⅰ型胶原混合液在室温下从中间通道的入口处轻轻注入,使细胞-Ⅰ型胶原混合液填满中间的通道以及两边的 8 个微横桥,在 37 ℃下聚合 30 min,使其完全聚合后,连接注射泵持续换液,放入孵箱中培养( 见图 ) 。
24 h 后用 FITC-鬼笔环肽进行细胞骨架染色。 步骤如下: 预温 PBS ( 37 ℃ ) 清洗细胞 2 次,每次 10 min; 4% 多聚甲醛室温固定 5 ~10 min,PBS清洗细胞 3 次; 0.1% Triton X-100 /PBS室温破膜 3~5 min,PBS清洗细胞 3 次; 5 μL FITC-鬼笔环肽贮存液加入150 μL PBS 中配成工作液( 5 μg /mL) 并用以染细胞,室温染色 30~60 min; PBS 清洗细胞 3次; 吸去多余水分,加荧光封片液封片,荧光显微镜下观察,并拍照。用上述方法对普通培养瓶培养细胞进行骨架染色,用作对照实验。
- 效果
细胞在胶原水凝胶三维支架结构中的培养 水凝胶材质均匀,可包埋细胞,更重要的是其与体 内胞外基质物理性质十分相似,有利于细胞伸展、迁 移以及活性表达,因此是细胞三维培养中十分理想 材料。
对Ⅰ型胶原水凝胶进行扫描电镜观察,发现 其聚合后,形成的生物多孔网络结构( 见图 ) ,该结 构具有较好的液体输运性质,有利于生化因子的交换与间隙渗流的生成。在微流控芯片中对细胞进行三维培养 24 h 后细胞形态如图所示。

- 二维和三维培养条件下的细胞形态学比较
对在通道中的水凝胶支架进行三维培养的细胞与 常规二维培养的细胞的骨架染色结果比较发现,二 维培养条件下贴壁生长的细胞骨架为平面线条排 布,而三维培养的细胞骨架呈由中心向四周发散的 射线状。
在真实的生理条件下,细胞通过紧密连接或缝隙连接等连接方式建立细胞间及细胞与胞外基质间的联系,形成一定的三维空间结构,细胞三维培养可为细胞提供类似体内生长环境的支架或基质,而与体内细胞生长情况更为相似;
此外,利用微流控芯片实现三维细胞培养,既能保留体内细胞三维生长的物质结构基础,又能体现细胞培养的直观性及条件可控制性,把细胞培养及其对微环境中不同参数应激响应的研究联系起来。
顶旭微控同类型芯片展示
© 2025. All Rights Reserved. 苏ICP备2022036544号-1















